Cómo representar una ecuación química de manera sencilla y precisa: Guía completa para entender la estructura y simbología
Entender y representar las ecuaciones químicas es fundamental para poder comprender y estudiar los procesos químicos que ocurren en nuestro entorno. Las ecuaciones químicas describen las reacciones químicas, es decir, los cambios que se producen cuando una o más sustancias se transforman en otras. Estas ecuaciones son representadas mediante símbolos y fórmulas específicas, lo cual puede resultar confuso para aquellos que no están familiarizados con la terminología y notación química.
Te presentaremos una guía completa para entender cómo representar una ecuación química de manera sencilla y precisa. Te explicaremos la estructura básica de una ecuación química y la simbología utilizada, como los coeficientes estequiométricos, los subíndices y los símbolos de los elementos químicos. Además, te daremos algunos ejemplos prácticos y consejos útiles para facilitar la comprensión y escritura de ecuaciones químicas. ¡Sigue leyendo para convertirte en un experto en el lenguaje de las reacciones químicas!
- Qué es una ecuación química y por qué es importante representarla de manera precisa
- Qué elementos se utilizan para representar cada componente de una ecuación química
- Cuál es la estructura básica de una ecuación química y qué información proporciona
- Cómo se balancea una ecuación química y qué importancia tiene este paso
- Cuál es la simbología utilizada en una ecuación química y cómo se interpreta
- Qué reglas debemos seguir al representar una ecuación química para asegurar su exactitud
- Qué herramientas o software podemos utilizar para representar ecuaciones químicas de manera sencilla
- Cómo se representan las reacciones químicas mediante diagramas o ilustraciones
- Cuáles son algunos ejemplos prácticos de ecuaciones químicas y su representación precisa
- Cómo podemos realizar ajustes o modificaciones en una ecuación química existente sin alterar su significado
- Qué recursos adicionales están disponibles para profundizar en el tema de representación de ecuaciones químicas
-
Preguntas frecuentes (FAQ)
- 1. ¿Qué es una ecuación química?
- 2. ¿Cómo se representa un elemento químico en una ecuación?
- 3. ¿Qué significa el número que acompaña a un elemento en una ecuación?
- 4. ¿Cómo se representan las sustancias en estado gaseoso, líquido o sólido en una ecuación química?
- 5. ¿Qué son los productos y reactivos en una ecuación química?
Qué es una ecuación química y por qué es importante representarla de manera precisa
Una ecuación química es una representación simbólica de una reacción química. En ella, se indican los reactantes y los productos involucrados, así como la proporción en la que estos interactúan. Las ecuaciones químicas son fundamentales para describir los cambios químicos que ocurren en una variedad de procesos, desde reacciones simples hasta complejas síntesis orgánicas.
Es importante representar una ecuación química de manera precisa porque proporciona información clave sobre las sustancias involucradas, los cambios que se producen y las condiciones en las que ocurren. La precisión en la representación de una ecuación química garantiza que se pueda entender correctamente el proceso químico en cuestión y facilita la comunicación eficaz entre los científicos.
Además, una representación precisa de una ecuación química permite realizar cálculos estequiométricos, determinar las cantidades exactas de sustancias que se necesitan o se producen en una reacción, tanto en términos de masa como de número de partículas. Esto es esencial para el diseño y la optimización de procesos químicos, así como para garantizar la seguridad y la eficiencia en el manejo y producción de productos químicos.
Qué elementos se utilizan para representar cada componente de una ecuación química
Para representar cada componente de una ecuación química se utilizan diferentes elementos y símbolos que nos permiten identificar y distinguir los distintos elementos químicos presentes en la reacción. A continuación, se detallan los principales elementos utilizados para esta representación:
Símbolos químicos:
Los símbolos químicos son representaciones abreviadas de los elementos químicos y se utilizan para identificar los distintos átomos presentes en una ecuación química. Cada elemento tiene un símbolo único formado por una o dos letras. Algunos ejemplos de símbolos químicos comunes son H para hidrógeno, O para oxígeno, Na para sodio, Cl para cloro, entre muchos otros.
Subíndices:
Los subíndices se utilizan para indicar la cantidad de átomos presentes de cada elemento en la ecuación química. Se colocan a la derecha del símbolo químico y se escriben en letra pequeña. Por ejemplo, en la fórmula H2O, el subíndice 2 indica que hay dos átomos de hidrógeno presentes.
Coeficientes estequiométricos:
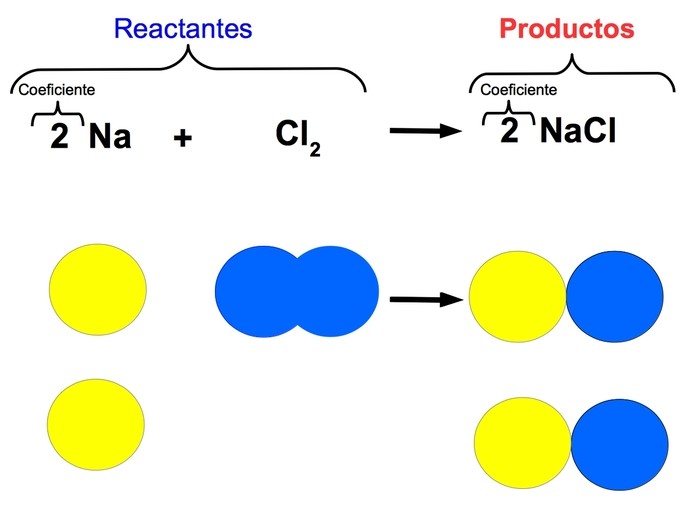
Los coeficientes estequiométricos se utilizan para indicar la proporción en la que reaccionan los diferentes componentes de una ecuación química. Se colocan delante de cada fórmula química y se escriben como números enteros. Estos coeficientes deben ser balanceados para que la ecuación química cumpla con la ley de la conservación de la masa. Por ejemplo, en la reacción 2 H2 + O2 → 2 H2O, el coeficiente 2 indica que dos moléculas de hidrógeno reaccionan con una molécula de oxígeno para formar dos moléculas de agua.
Flechas:
Las flechas se utilizan para indicar la dirección de la reacción química. En una ecuación química, la flecha apunta hacia la derecha para indicar la formación de nuevos productos a partir de los reactivos. En algunos casos, también se utiliza una doble flecha para indicar que la reacción es reversible y puede ir en ambas direcciones.
Estado de agregación:
El estado de agregación se utiliza para indicar el estado físico de las sustancias presentes en una ecuación química. Algunos estados de agregación comunes son sólido (s), líquido (l), gaseoso (g) o acuoso (aq). Se colocan entre paréntesis después de la fórmula química correspondiente.
La representación de una ecuación química utiliza símbolos químicos, subíndices, coeficientes estequiométricos, flechas y estados de agregación para identificar y describir los diferentes elementos, su proporción y su estado físico involucrados en una reacción química.
Cuál es la estructura básica de una ecuación química y qué información proporciona
Una ecuación química es una representación simbólica de una reacción química. Esta estructura básica se compone de tres partes principales: los reactivos, el símbolo de la flecha que indica la dirección de la reacción y los productos.
Los reactivos son las sustancias químicas iniciales que interactúan entre sí en una reacción química. Se representan a la izquierda del símbolo de la flecha y se separan entre sí por el signo "+" para indicar que están presentes en la misma fase. Por ejemplo, en la ecuación química:
2H2O + O2 → 2H2O
Los reactivos son el agua (H2O) y el oxígeno (O2) y ambos se encuentran en estado gaseoso. La "2" que precede al agua indica que hay dos moléculas de agua presentes en la reacción.
El símbolo de la flecha, representado por "->" o "→", indica la dirección de la reacción química, es decir, hacia dónde se dirigen los reactivos para formar los productos.
Por último, los productos son las sustancias resultantes de la reacción y se representan a la derecha del símbolo de la flecha. Al igual que los reactivos, se separan entre sí por el signo "+". Siguiendo el ejemplo anterior, los productos son dos moléculas de agua (H2O).
La ecuación química proporciona información sobre los reactivos y los productos, así como las proporciones en las que se combinan. También indica si la reacción es reversible o irreversible, dependiendo del tipo de flecha utilizada.
La estructura básica de una ecuación química consta de reactivos, el símbolo de la flecha y los productos. Proporciona información sobre los componentes de la reacción, sus proporciones y la dirección de la reacción.
Cómo se balancea una ecuación química y qué importancia tiene este paso
Balancear una ecuación química es uno de los pasos más importantes al representar una reacción química. Una ecuación balanceada muestra de manera precisa las cantidades relativas de átomos y moléculas que intervienen en la reacción, lo que permite comprender mejor los cambios químicos que tienen lugar.
Para balancear una ecuación química, se debe asegurar que el número de átomos de cada elemento en los reactivos sea igual al número de átomos de ese mismo elemento en los productos. Esto se logra ajustando los coeficientes estequiométricos de las especies químicas involucradas en la ecuación.
El objetivo principal del balanceo de una ecuación química es cumplir con la Ley de la Conservación de la Masa, la cual establece que la masa total de los reactivos debe ser igual a la masa total de los productos. Al balancear correctamente una ecuación, se garantiza que esta ley se cumple y se conserva la cantidad de materia antes y después de la reacción.
Un aspecto clave al balancear una ecuación química es respetar el principio de conservación de la carga eléctrica. Esto implica que la suma de las cargas en los reactivos debe ser igual a la suma de las cargas en los productos. De esta forma, se asegura que no se generen cargas eléctricas desequilibradas durante la reacción.
En general, para balancear una ecuación química se siguen algunos pasos básicos:
- Identificar los reactivos y productos de la ecuación.
- Determinar los átomos presentes en cada especie química.
- Contar el número de átomos de cada elemento en los reactivos y productos.
- Ajustar los coeficientes estequiométricos de las especies químicas para igualar el número de átomos de cada elemento.
- Verificar que se cumpla la conservación de la masa y la carga eléctrica.
Es importante mencionar que existen diferentes métodos para balancear una ecuación química, como el método del tanteo, el método del ion-electrón (también conocido como método redox) o el método de matrices. Cada método tiene sus propias ventajas y puede resultar más adecuado según el tipo de reacción química.
Balancear una ecuación química es fundamental para representar correctamente una reacción química y comprender los cambios que ocurren a nivel molecular. Al ajustar los coeficientes estequiométricos de las especies químicas involucradas, se garantiza que se cumple la conservación de la masa y la carga eléctrica, lo que permite tener una representación precisa y sencilla de la ecuación química.
Cuál es la simbología utilizada en una ecuación química y cómo se interpreta
En una ecuación química, se utilizan varios símbolos y elementos para representar los diferentes componentes de una reacción química. Estos símbolos se basan en la tabla periódica de los elementos y siguen ciertas reglas específicas.
Para comenzar, cada elemento químico tiene un símbolo único que lo representa, como el "H" para el hidrógeno o "O" para el oxígeno. Estos símbolos se escriben en mayúsculas y, en algunos casos, pueden ir acompañados por un subíndice para indicar su número de átomos presentes en la reacción.
Por ejemplo, si tenemos una ecuación química que muestra la formación de agua a partir de hidrógeno y oxígeno, la ecuación sería:
2H2 + O2 → 2H2O
En esta ecuación, el número 2 antes del símbolo del hidrógeno indica que hay dos moléculas de hidrógeno involucradas en la reacción. De manera similar, el número 2 antes del símbolo del agua indica que también hay dos moléculas de agua resultante.
Además de los símbolos de los elementos, las ecuaciones químicas también pueden incluir otros símbolos y anotaciones para representar diferentes características de la reacción. Por ejemplo, las flechas (→ o ↔) se utilizan para indicar la dirección de la reacción: hacia los productos o hacia los reactivos.
Además, los coeficientes son utilizados para indicar el número de moléculas o átomos involucrados en la reacción. Estos se colocan antes de los símbolos de los elementos y pueden ser números enteros o fraccionarios.
Por último, los estados físicos de las sustancias también pueden ser señalados mediante subíndices adicionales en forma de letras. Por ejemplo, "g" indica gas, "l" indica líquido, "s" indica sólido y "aq" indica una sustancia soluble en agua (disuelta en agua).
La simbología utilizada en una ecuación química es fundamental para entender y representar de manera precisa una reacción química. Los símbolos de los elementos, los coeficientes, los estados físicos y las flechas son algunas de las herramientas utilizadas para describir los componentes y procesos químicos involucrados en una ecuación.
Qué reglas debemos seguir al representar una ecuación química para asegurar su exactitud
Cuando representamos una ecuación química, es importante seguir ciertas reglas para asegurar su exactitud y comprensión. Estas reglas nos ayudan a mantener consistencia en la estructura y simbología utilizada, facilitando así su interpretación por parte de otros científicos.
1. Balancear la ecuación
Antes de comenzar a representar una ecuación química, es fundamental balancearla. Esto significa igualar el número de átomos de cada elemento en los reactivos y productos. El equilibrio en una ecuación química es esencial para expresar correctamente las relaciones entre los diferentes compuestos involucrados.
2. Usar sobíndices y coeficientes
Para indicar el número de átomos o moléculas en una ecuación química, se utilizan sobíndices y coeficientes respectivamente. Los sobíndices son pequeños números escritos después del símbolo de un elemento, mientras que los coeficientes son números escritos antes de los símbolos o fórmulas. Estos elementos permiten una representación precisa de la cantidad de cada sustancia involucrada en la reacción.
3. Indicar estados de agregación
Es importante incluir los estados de agregación de las sustancias presentes en la ecuación química. Algunos ejemplos comunes de estados de agregación son: (g) para gas, (l) para líquido, (s) para sólido y (aq) para solución acuosa. Esta información adicional ayuda a contextualizar la reacción y comprender mejor las condiciones en las que ocurre.
4. Utilizar flechas y símbolos adecuados
Las ecuaciones químicas se representan mediante el uso de flechas, las cuales indican la dirección de la reacción. Una flecha simple (→) representa una reacción irreversible, mientras que una doble flecha (⇌) indica una reacción reversible. Además, es importante utilizar los símbolos químicos adecuados para cada elemento. Estos símbolos son abreviaturas de uno o dos caracteres que permiten identificar los elementos presentes en la ecuación.
5. Incluir condiciones y catalizadores
En algunos casos, es necesario especificar las condiciones en las que ocurre la reacción, como temperatura, presión o luz. Asimismo, si la reacción requiere un catalizador para llevarse a cabo, este debe ser indicado. Estas condiciones adicionales ayudan a entender mejor los factores que influyen en la reacción química y su cinética.
Al seguir estas reglas al representar una ecuación química, podremos asegurar su exactitud y facilitar su comprensión por parte de otros científicos. Una correcta estructura y simbología nos permite comunicar de manera precisa las transformaciones químicas que tienen lugar en una determinada reacción.
Qué herramientas o software podemos utilizar para representar ecuaciones químicas de manera sencilla
Existen diferentes herramientas y software disponibles que podemos utilizar para representar ecuaciones químicas de manera sencilla y precisa. Estas herramientas nos permiten crear y editar ecuaciones químicas utilizando una variedad de símbolos y convenciones que son reconocidos internacionalmente.
1. Microsoft Word
Una opción comúnmente utilizada para representar ecuaciones químicas es Microsoft Word. En Word, podemos usar el editor de ecuaciones para crear fórmulas químicas y ecuaciones completas. El editor de ecuaciones tiene una interfaz amigable que nos permite seleccionar símbolos y operadores químicos fácilmente. Podemos agregar subíndices, superíndices, fracciones y otros elementos necesarios para representar la ecuación química correctamente.
2. LaTeX
Otra herramienta popular para representar ecuaciones químicas es LaTeX. LaTeX es un sistema de composición tipográfica utilizado ampliamente en campos científicos y matemáticos. Con LaTeX, podemos escribir fórmulas químicas utilizando una sintaxis específica que permite la representación de ecuaciones complejas de manera clara y precisa. LaTeX ofrece una amplia gama de comandos y paquetes diseñados específicamente para trabajar con símbolos y fórmulas químicas.
3. ChemDraw
ChemDraw es un software específicamente diseñado para dibujar estructuras y representar ecuaciones químicas. Este software cuenta con una amplia biblioteca de símbolos y plantillas predefinidas que facilitan la creación de ecuaciones químicas complejas. ChemDraw también permite la exportación de las ecuaciones a formatos compatibles con otros programas y documentos.
4. ChemOffice
Otra opción es utilizar ChemOffice, una suite de software que incluye varias herramientas relacionadas con la química. Una de estas herramientas es ChemDraw, mencionada anteriormente, que permite la representación de ecuaciones químicas. Además, ChemOffice ofrece otras herramientas para la visualización y análisis de estructuras químicas, así como la gestión de datos e informes en el ámbito de la química.
Estas son solo algunas de las herramientas y software disponibles para representar ecuaciones químicas de manera sencilla y precisa. Es importante explorar diferentes opciones y elegir la que mejor se adapte a nuestras necesidades y preferencias. Recuerda siempre verificar y revisar tus ecuaciones químicas para garantizar su exactitud y coherencia.
Cómo se representan las reacciones químicas mediante diagramas o ilustraciones
Las reacciones químicas se representan de manera visual mediante diagramas o ilustraciones que permiten entender mejor los elementos, compuestos y cambios que ocurren durante el proceso. Estas representaciones gráficas son cruciales para comunicar y entender las reacciones químicas, especialmente cuando se trata de ecuaciones químicas complejas.
Existen diferentes formas de representar una ecuación química, pero la más común es mediante la notación de fórmula desarrollada. En esta notación, se utilizan símbolos químicos para representar los elementos químicos y números subíndices para indicar la cantidad de átomos de cada elemento en la molécula.
Elementos y compuestos
En la representación de una ecuación química, es importante distinguir entre elementos y compuestos. Los elementos se representan mediante sus símbolos químicos, que son abreviaturas de una o dos letras. Por ejemplo, el símbolo del hidrógeno es "H", mientras que el símbolo del oxígeno es "O".
Los compuestos, por otro lado, se representan utilizando los símbolos químicos de los elementos que los componen. Estos símbolos están escritos en un orden específico que indica la proporción de cada elemento en la molécula del compuesto. Por ejemplo, el agua se representa como H2O, lo que significa que está compuesta por dos átomos de hidrógeno y uno de oxígeno.
Cambios y balanceo de ecuaciones químicas
Las reacciones químicas implican cambios en los elementos y compuestos involucrados. Estos cambios se representan mediante las flechas que indican la dirección de la reacción. La flecha hacia la derecha (→) indica los productos de la reacción, mientras que la flecha hacia la izquierda (<-) señala los reactantes.
Es importante destacar que las ecuaciones químicas deben estar balanceadas para indicar que la cantidad de átomos y carga eléctrica se conserva antes y después de la reacción. Esto se logra agregando coeficientes estequiométricos a los símbolos químicos de los compuestos. Por ejemplo, la ecuación química balanceada para la reacción de formación del agua es:
2H2 + O2 → 2H2O
En esta ecuación, el coeficiente "2" indica que necesitamos dos moléculas de hidrógeno y una molécula de oxígeno para formar dos moléculas de agua.
Además de estas representaciones básicas, también se utilizan otros símbolos y convenciones en las ecuaciones químicas, como la notación de estado físico (por ejemplo, "(g)" para gas y "(s)" para sólido) y los números de oxidación en los iones. Estos detalles adicionales ayudan a proporcionar más información sobre las condiciones y características de la reacción química.
Ejemplos de representación de ecuaciones químicas
Para ilustrar mejor cómo se representan las ecuaciones químicas, aquí hay algunos ejemplos:
- Reacción de combustión del metano: CH4 + 2O2 → CO2 + 2H2O
- Reacción de neutralización entre ácido clorhídrico y hidróxido de sodio: HCl + NaOH → NaCl + H2O
- Reacción de descomposición del peróxido de hidrógeno: 2H2O2 → 2H2O + O2
Estos ejemplos muestran diferentes tipos de reacciones químicas y cómo se representan mediante la notación de fórmula desarrollada y el balanceo adecuado de los coeficientes estequiométricos.
Representar una ecuación química de manera sencilla y precisa requiere utilizar símbolos químicos, números subíndices, coeficientes estequiométricos y otros detalles adicionales. Estas representaciones gráficas son esenciales para comprender y comunicar las reacciones químicas de manera efectiva.
Cuáles son algunos ejemplos prácticos de ecuaciones químicas y su representación precisa
Las ecuaciones químicas son representaciones simbólicas de reacciones químicas, en las cuales se describen los reactantes y los productos involucrados, así como las proporciones en las que interactúan. A continuación, veremos algunos ejemplos prácticos de ecuaciones químicas y cómo se representan de manera precisa:
Ejemplo 1: Combustión del metano (CH4)
La combustión del metano es una reacción química muy común. Se representa de la siguiente manera:
CH4 + 2O2 → CO2 + 2H2O
En esta ecuación, el metano (CH4) se combina con el oxígeno (O2) para formar dióxido de carbono (CO2) y agua (H2O).
Ejemplo 2: Reacción de neutralización entre ácido clorhídrico (HCl) e hidróxido de sodio (NaOH)
La reacción de neutralización es aquella en la cual un ácido y una base reaccionan para formar una sal y agua. En este caso, la reacción entre ácido clorhídrico (HCl) e hidróxido de sodio (NaOH) se representa de la siguiente forma:
HCl + NaOH → NaCl + H2O
En esta ecuación, el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH) reaccionan para formar cloruro de sodio (NaCl) y agua (H2O).
Ejemplo 3: Descomposición del peróxido de hidrógeno (H2O2)
La descomposición es una reacción en la cual una sustancia se separa en dos o más productos diferentes. En el caso del peróxido de hidrógeno (H2O2), su descomposición se representa de la siguiente manera:
2H2O2 → 2H2O + O2
En esta ecuación, el peróxido de hidrógeno (H2O2) se descompone en agua (H2O) y oxígeno (O2). Es importante mencionar que los coeficientes numéricos indican las proporciones molares en las que se encuentran los reactantes y productos.
Ejemplo 4: Reacción de oxidación-reducción entre el cobre (Cu) y el ácido nítrico (HNO3)
Las reacciones de oxidación-reducción son aquellas en las cuales hay transferencia de electrones entre los reactantes. En el caso de la reacción entre el cobre (Cu) y el ácido nítrico (HNO3), se representa de la siguiente manera:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
En esta ecuación, el cobre (Cu) reacciona con el ácido nítrico (HNO3) para formar nitrato de cobre (Cu(NO3)2), óxido nítrico (NO) y agua (H
Estos son solo algunos ejemplos prácticos de ecuaciones químicas y su representación precisa. Como puedes observar, la estructura de las ecuaciones químicas es fundamental para comprender qué reactivos interactúan y qué productos se forman en una reacción química determinada.
Cómo podemos realizar ajustes o modificaciones en una ecuación química existente sin alterar su significado
Modificar una ecuación química existente puede ser necesario en algunos casos para reflejar con mayor precisión los procesos o reacciones que ocurren en un sistema. Es importante tener en cuenta que cualquier modificación realizada debe mantener la veracidad y significado de la ecuación original.
Para realizar ajustes o modificaciones en una ecuación química sin alterar su significado, es fundamental comprender la estructura y simbología utilizada en las ecuaciones químicas. Estas representaciones gráficas tienen reglas específicas que deben respetarse para garantizar la exactitud de la información transmitida.
Pasos para ajustar o modificar una ecuación química existente:
- Analizar los cambios necesarios: Antes de realizar cualquier modificación, es importante analizar detenidamente la ecuación química existente y determinar qué cambios son necesarios. Esto puede incluir agregar o eliminar sustancias, ajustar los coeficientes estequiométricos o modificar las condiciones de reacción.
- Utilizar los coeficientes estequiométricos: Los coeficientes estequiométricos en una ecuación química indican la proporción molar en la que reaccionan las diferentes sustancias. Al ajustar una ecuación, es posible cambiar estos coeficientes para reflejar las necesidades del proceso. Sin embargo, es importante hacerlo de manera proporcional y siguiendo las leyes de la conservación de la masa y la carga eléctrica.
- Agregar o eliminar sustancias: En algunos casos, puede ser necesario agregar o eliminar sustancias de una ecuación química para representar con mayor precisión un proceso. Al hacerlo, es fundamental tener en cuenta las reglas de nomenclatura y simbología química para asegurar la consistencia y comprensión de la ecuación.
- Modificar condiciones de reacción: Las condiciones de reacción, como la temperatura, presión o catalizadores utilizados, pueden influir en el resultado de una reacción química. Si se requiere ajustar estas condiciones, es importante modificar la ecuación correspondiente para reflejar los cambios de manera precisa.
Es crucial tener en cuenta que cualquier ajuste o modificación realizado en una ecuación química debe ser respaldado por sólidos fundamentos científicos y estar respaldado por evidencia experimental o cálculos teóricos.
Qué recursos adicionales están disponibles para profundizar en el tema de representación de ecuaciones químicas
Si estás interesado en profundizar más en el tema de la representación de ecuaciones químicas, existen diversos recursos adicionales que pueden ser de utilidad. A continuación, te menciono algunos de ellos:
Libros especializados
- Ecuaciones Químicas: Teoría y Práctica: Este libro escrito por expertos en el tema ofrece una completa guía sobre la representación de ecuaciones químicas, desde los fundamentos teóricos hasta ejemplos prácticos.
- Química General Avanzada: Esta obra cubre diferentes aspectos de la química, incluyendo la representación de ecuaciones químicas de una manera más detallada y con un enfoque hacia temas avanzados.
Cursos en línea
- Introducción a la Representación de Ecuaciones Químicas: Este curso en línea ofrece una introducción completa al tema, presentando conceptos básicos, ejemplos prácticos y ejercicios para practicar la representación de ecuaciones químicas.
- Química para Principiantes: Representación de Ecuaciones Químicas Simplificada: Este curso está diseñado especialmente para principiantes en química y brinda una visión sencilla y fácil de entender sobre la representación de ecuaciones químicas.
Software y herramientas de representación de ecuaciones químicas
- ChemDraw: Es una herramienta ampliamente utilizada en la industria química y académica para crear representaciones precisas de ecuaciones químicas. Ofrece una amplia gama de funciones y opciones de personalización.
- ChemDoodle: Este software permite dibujar estructuras químicas y representar ecuaciones químicas de una manera profesional. Es compatible con diferentes formatos y ofrece un conjunto completo de herramientas de edición.
Recuerda que estos recursos adicionales pueden ser de gran ayuda para expandir tus conocimientos sobre la representación de ecuaciones químicas, pero es importante complementarlos con práctica y estudio autodidacta. ¡No dudes en aprovecharlos para profundizar en el tema!
Preguntas frecuentes (FAQ)
1. ¿Qué es una ecuación química?
Una ecuación química es la representación simbólica de una reacción química, mostrando los compuestos presentes antes y después de la reacción.
2. ¿Cómo se representa un elemento químico en una ecuación?
Los elementos químicos se representan utilizando símbolos que corresponden a su nombre o a una abreviatura, por ejemplo: H para el hidrógeno o Na para el sodio.
3. ¿Qué significa el número que acompaña a un elemento en una ecuación?
El número que acompaña a un elemento, llamado coeficiente, indica la cantidad de átomos o moléculas involucradas en la reacción química.
4. ¿Cómo se representan las sustancias en estado gaseoso, líquido o sólido en una ecuación química?
Las sustancias en estado gaseoso se representan con la letra "g", las sustancias en estado líquido con la letra "l" y las sustancias en estado sólido con la letra "s".
5. ¿Qué son los productos y reactivos en una ecuación química?
Los reactivos son las sustancias que se combinan o descomponen durante una reacción química, mientras que los productos son las sustancias resultantes de dicha reacción.
Deja una respuesta
Entradas relacionadas