¡Descubre quién propuso la ley de las proporciones definidas y revoluciona tu conocimiento químico hoy!
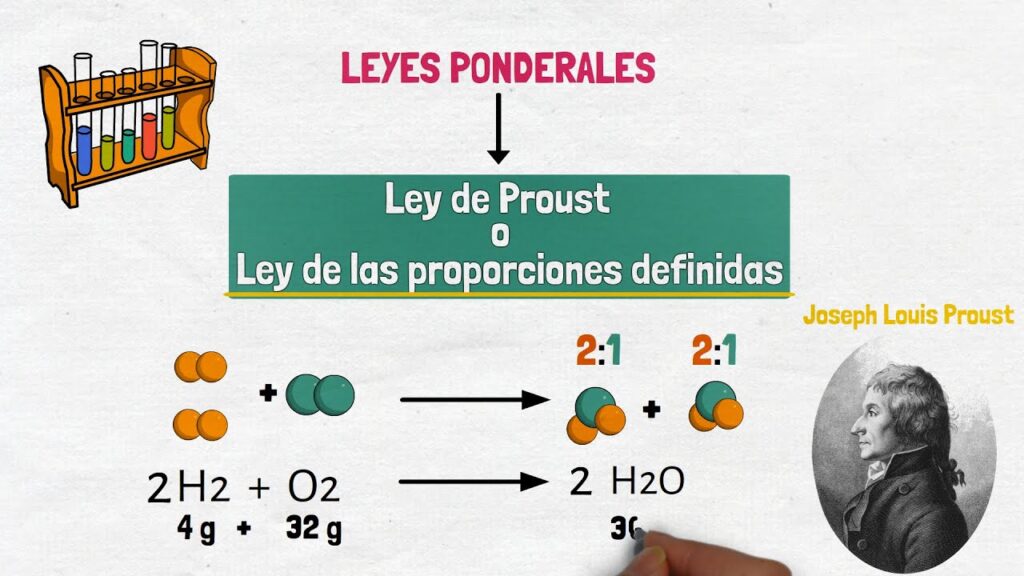
La ley de las proporciones definidas es un principio básico en la química que establece que los elementos en un compuesto siempre se combinan en proporciones fijas y definidas. Esta idea fundamental fue propuesta por el químico francés Joseph Louis Proust a finales del siglo XVIII, revolucionando nuestro entendimiento de cómo los elementos se combinan para formar compuestos químicos.
Exploraremos la vida y el trabajo de Joseph Louis Proust, su descubrimiento de la ley de las proporciones definidas y su impacto en la historia de la química. También discutiremos cómo esta ley sienta las bases para nuestra comprensión actual de la composición de los compuestos químicos y cómo ha influenciado en el desarrollo de la química moderna.
- Quién fue el científico que propuso la ley de las proporciones definidas
- Qué es la ley de las proporciones definidas y cómo revoluciona nuestro conocimiento químico
- Cuáles son los fundamentos de la ley de las proporciones definidas
- Cómo se aplica la ley de las proporciones definidas en la vida cotidiana
- Cuál es la importancia de la ley de las proporciones definidas para la investigación científica y la industria química
- Existen excepciones o limitaciones a la ley de las proporciones definidas
- Cuál es la relación entre la ley de las proporciones definidas y otros conceptos químicos como la estequiometría
- Cuáles son algunos ejemplos y experimentos que demuestran la validez de la ley de las proporciones definidas
- Qué papel desempeñó la ley de las proporciones definidas en el desarrollo de la tabla periódica y la comprensión de los elementos químicos
- Qué avances científicos y tecnológicos han resultado de la aplicación de la ley de las proporciones definidas
- Preguntas frecuentes (FAQ)
Quién fue el científico que propuso la ley de las proporciones definidas
La ley de las proporciones definidas en química fue propuesta por el científico francés Joseph Louis Proust en el siglo XVIII. Proust es reconocido como uno de los principales pioneros de la química moderna y sus investigaciones sentaron las bases para numerosos avances en esta disciplina.
Proust nació el 26 de septiembre de 1754 en Angers, Francia. A lo largo de su carrera, realizó importantes contribuciones tanto teóricas como experimentales. Sin embargo, una de las mayores aportaciones de Proust a la química fue la formulación y demostración de la ley de las proporciones definidas.
La ley de las proporciones definidas establece que una sustancia pura siempre está compuesta por elementos que se combinan en proporciones determinadas y fijas. Esto significa que, independientemente de la cantidad de sustancia que se haya formado o se vaya a formar, las proporciones entre los elementos que la componen siempre serán las mismas.
Para demostrar esta ley, Proust realizó una serie de experimentos con diferentes combinaciones químicas. En uno de estos experimentos más conocidos, estudió la reacción entre óxidos de cobre y ácidos clorhídrico y nítrico. Los resultados obtenidos confirmaron la ley de las proporciones definidas y fueron fundamentales para su aceptación por parte de la comunidad científica.
La formulación de la ley de las proporciones definidas por parte de Proust revolucionó el campo de la química, ya que permitió establecer la base para el desarrollo posterior de la teoría atómica. Además, sentó las bases para el estudio y comprensión de las propiedades y reacciones químicas.
En reconocimiento a sus importantes contribuciones, se le otorgó a Proust la medalla Copley en 1799 por parte de la Royal Society de Londres. Esta distinción es considerada como uno de los mayores reconocimientos en el campo de la química y representa el legado duradero de Proust en el ámbito científico.
Qué es la ley de las proporciones definidas y cómo revoluciona nuestro conocimiento químico
La ley de las proporciones definidas, también conocida como la ley de las constantes definidas, es uno de los fundamentos clave en la química. Esta ley establece que cuando los elementos se combinan para formar compuestos, lo hacen en proporciones fijas y definidas por masa.
Esta ley fue propuesta por el químico francés Joseph Louis Proust en 1799 y fue un avance revolucionario en el campo de la química. Antes de su descubrimiento, se creía que los compuestos podían tener proporciones variables entre los elementos que los conforman. Sin embargo, Proust demostró que esto no era cierto y que existen relaciones consistentes entre las masas de los elementos en un compuesto dado.
La importancia de la ley de las proporciones definidas radica en que proporciona una base sólida para el estudio de la química. Permite predecir, calcular y entender cómo los elementos se combinan para formar sustancias nuevas. Esto ha llevado al desarrollo de diversos campos como la estequiometría y la síntesis química.
Ejemplos prácticos de la ley de las proporciones definidas
Para comprender mejor esta ley, consideremos el ejemplo de la formación de agua (H2O). Según la ley de las proporciones definidas, la relación de masa entre el hidrógeno y el oxígeno siempre será de 2:16 (o simplificando a 1:8). Esto significa que en cualquier muestra de agua, habrá dos veces la cantidad de hidrógeno en comparación con el oxígeno.
Otro ejemplo es la formación de dióxido de carbono (CO2). La ley de las proporciones definidas establece que por cada átomo de carbono en el compuesto, debe haber dos átomos de oxígeno. Esto significa que la relación de masa entre el carbono y el oxígeno siempre será de 12:32 (simplificada a 3:8).
Estos ejemplos demuestran cómo la ley de las proporciones definidas permite predecir la cantidad relativa de elementos en un compuesto dado y cómo esta relación se mantiene constante independientemente de la cantidad de sustancia presente.
Aplicaciones de la ley de las proporciones definidas
La ley de las proporciones definidas tiene numerosas aplicaciones en la química. Es especialmente útil en el campo de la estequiometría, que se ocupa de calcular y estudiar las relaciones entre las cantidades de reactantes y productos en una reacción química.
También es fundamental en la síntesis química, ya que permite determinar las cantidades adecuadas de los reactivos necesarios para producir una sustancia específica. Al comprender las proporciones definidas, los químicos pueden evitar el desperdicio de materiales y optimizar los procesos de producción.
La ley de las proporciones definidas es un concepto central en la química que revoluciona nuestro conocimiento sobre cómo los elementos se combinan para formar compuestos. Esta ley, propuesta por Proust, establece que las masas de los elementos en un compuesto dado se combinan siempre en proporciones fijas y consistentes. Esta regla fundamental ha permitido el avance de la estequiometría y la síntesis química, y tiene aplicaciones prácticas en diversas industrias.
Cuáles son los fundamentos de la ley de las proporciones definidas
La ley de las proporciones definidas, también conocida como ley de Proust, es un principio fundamental en la química que establece que los elementos químicos se combinan entre sí en proporciones fijas y consistentes para formar compuestos químicos. Fue propuesta por el químico francés Joseph Louis Proust en el siglo XVIII y sentó las bases para el desarrollo de la estequiometría, la rama de la ciencia que estudia las relaciones cuantitativas en las reacciones químicas.
De acuerdo con la ley de las proporciones definidas, cada compuesto químico tiene una relación fija de átomos de diferentes elementos. Esto significa que, sin importar cómo se forme o en qué cantidad, un compuesto siempre tendrá la misma proporción de átomos de sus constituyentes. Por ejemplo, el agua (H2O) siempre estará compuesta por dos átomos de hidrógeno y uno de oxígeno, sin importar la fuente.
Esta ley fue un paso importante en la comprensión de la naturaleza de la materia y permitió a los científicos desarrollar métodos precisos de análisis químico. A través de experimentos meticulosos, Proust pudo demostrar que esta relación constante de elementos en los compuestos es una característica esencial de la química.
Los experimentos de Proust
- Para confirmar su hipótesis sobre las proporciones fijas en los compuestos químicos, Proust llevó a cabo una serie de experimentos. En uno de ellos, calentó nitrato de mercurio (Hg(NO3)2) hasta que se descompuso. Observó que el mercurio liberado siempre tenía una relación fija con respecto al nitrógeno y al oxígeno presentes en el compuesto original.
- En otro experimento, Proust analizó diferentes muestras de carbonato de cobre(II) (CuCO3). Descubrió que, independientemente de la fuente del compuesto o su masa, siempre contenía una proporción constante de cobre, carbono y oxígeno.
Estos y otros experimentos realizados por Proust respaldaron la idea de que los elementos se combinan entre sí en proporciones definidas y consistentes para formar compuestos. Su trabajo allanó el camino para futuros avances en la química y sentó las bases para el desarrollo de la ley de conservación de la masa y la teoría atómica de Dalton.
Cómo se aplica la ley de las proporciones definidas en la vida cotidiana
La ley de las proporciones definidas, también conocida como ley de Proust, fue formulada por el químico francés Joseph Louis Proust en el siglo XVIII. Esta ley establece que en un compuesto químico determinado, los elementos siempre se combinan en proporciones fijas y constantes.
Esta ley es fundamental para entender la composición de los compuestos químicos y su importancia no se limita solo al ámbito de la ciencia. La aplicación de la ley de las proporciones definidas es evidente en diversos aspectos de nuestra vida cotidiana, desde la cocina hasta la industria farmacéutica.
En la cocina
En la cocina, la ley de las proporciones definidas se aplica a diario. Por ejemplo, cuando preparamos una receta que requiere la mezcla de ingredientes, es esencial seguir las proporciones adecuadas para obtener el resultado deseado.
Tomemos como ejemplo la preparación de una simple masa para galletas. Si seguimos una receta que indica una taza de harina, media taza de azúcar y una barra de mantequilla, estamos siguiendo la ley de las proporciones definidas. Al seguir estas cantidades específicas, logramos obtener una masa con las características deseadas, como una textura adecuada y el sabor equilibrado.
En la industria farmacéutica
Otro campo en el que la ley de las proporciones definidas juega un papel crucial es la industria farmacéutica. En esta industria, es fundamental garantizar que los medicamentos se produzcan con precisión y cumplan con las proporciones adecuadas de los ingredientes activos.
La ley de las proporciones definidas asegura que la cantidad de cada componente en un medicamento sea precisa y constante. Esto es esencial para garantizar que los pacientes reciban la dosis adecuada y obtengan los resultados deseados durante el tratamiento.
En la producción de materiales
Además de la cocina y la industria farmacéutica, la ley de las proporciones definidas también se aplica en la producción de materiales utilizados en varios sectores, como la construcción y la electrónica.
Por ejemplo, al fabricar cemento, se deben seguir las proporciones adecuadas de los ingredientes, como la mezcla de cemento, arena y agua, para lograr resistencia y durabilidad en la construcción de edificios y estructuras. De manera similar, en la industria electrónica, las aleaciones y compuestos que se utilizan en la fabricación de componentes electrónicos también siguen las proporciones definidas para garantizar su funcionalidad y rendimiento.
La ley de las proporciones definidas es una regla fundamental en química y tiene aplicaciones prácticas en nuestra vida cotidiana. Ya sea en la cocina, la industria farmacéutica o la producción de materiales, esta ley nos ayuda a comprender cómo los elementos se combinan en proporciones constantes y fijas, lo que es esencial para obtener resultados consistentes y predecibles en diversos ámbitos.
Cuál es la importancia de la ley de las proporciones definidas para la investigación científica y la industria química
La ley de las proporciones definidas, también conocida como ley de Dalton, es uno de los principios fundamentales en el campo de la química. Esta ley establece que los elementos que forman un compuesto químico siempre se combinan en proporciones fijas y definidas por masa.
Esta ley fue propuesta por el químico inglés John Dalton en el siglo XIX y revolucionó nuestra comprensión de la química. Antes de esta ley, no se entendía completamente cómo los distintos elementos se combinaban para formar sustancias específicas. La ley de las proporciones definidas estableció que la relación entre las masas de los elementos en un compuesto era constante y predecible.
La importancia de esta ley en la investigación científica es incalculable. Al comprender que las proporciones de los elementos en un compuesto son constantes, los científicos pueden analizar y diseñar reacciones químicas de manera más precisa. Esta comprensión ha llevado al descubrimiento y desarrollo de muchos compuestos químicos que tienen aplicaciones en diferentes campos, como la medicina, la agricultura y la tecnología.
En la industria química, la ley de las proporciones definidas es esencial para fabricar productos químicos de alta calidad y asegurar su consistencia. Los procesos de producción deben seguir las proporciones definidas para garantizar que los productos cumplan con los estándares requeridos. Además, esta ley también es fundamental para la síntesis química, donde los científicos deben precisar las cantidades exactas de los reactivos necesarios para obtener los productos deseados.
Además, la ley de las proporciones definidas ha sido clave en la determinación de las fórmulas químicas. Al analizar los pesos atómicos de los elementos en una muestra, se pueden determinar las relaciones de masa y, a partir de ellas, obtener las fórmulas moleculares o empíricas de los compuestos.
La ley de las proporciones definidas es un principio fundamental en la química que establece que los elementos en un compuesto se combinan en proporciones constantes y predecibles. Esta ley es de vital importancia tanto para la investigación científica como para la industria química, ya que permite comprender y diseñar reacciones químicas de manera más precisa y asegurar la consistencia de los productos químicos fabricados.
Existen excepciones o limitaciones a la ley de las proporciones definidas
Si bien la ley de las proporciones definidas es una regla fundamental en la química, existen algunas excepciones o limitaciones que vale la pena mencionar. Aunque estas excepciones no niegan la validez de la ley, nos ayudan a comprender mejor los casos en los que las proporciones pueden variar.
Una excepción a la ley de las proporciones definidas es conocida como la ley de las proporciones múltiples. Esta ley afirma que cuando dos elementos pueden combinarse para formar diferentes compuestos, la masa de uno de los elementos se mantiene constante mientras la masa del otro elemento varía en relación con las diferentes proporciones en las que se combinan.
Un ejemplo clásico de esta excepción es la combinación del carbono y el oxígeno para formar monóxido de carbono (CO) y dióxido de carbono (CO2). Siempre que haya exactamente una parte de carbono, el monóxido de carbono contendrá una parte de oxígeno. Sin embargo, cuando hay dos partes de carbono, el dióxido de carbono contendrá dos partes de oxígeno. Aquí, la proporción de oxígeno cambia según las diferentes combinaciones con el carbono.
Otra excepción importante es la ley de las proporciones equivalentes. Esta ley sugiere que cuando dos elementos o compuestos diferentes reaccionan con un tercer reactivo en una relación constante, las masas de los dos primeros están relacionadas por una razón simple de números enteros.
Un ejemplo común de esta excepción es la neutralización en la cual un ácido reacciona con una base para formar sal y agua. En tales reacciones, las masas de ácido y base que se requieren para neutralizar completamente la solución están relacionadas por razones simples de números enteros.
Aunque la ley de las proporciones definidas es generalmente aplicable en una variedad de situaciones químicas, existen excepciones interesantes que expanden nuestra comprensión de las propiedades únicas de ciertos elementos y compuestos. Estas excepciones nos enseñan que la química es un campo dinámico y complejo, y que siempre hay más por descubrir y explorar.
Cuál es la relación entre la ley de las proporciones definidas y otros conceptos químicos como la estequiometría
La ley de las proporciones definidas, también conocida como ley de las proporciones constantes o ley de Proust, fue propuesta por el químico francés Joseph Louis Proust en el siglo XVIII. Esta ley establece que en una sustancia química dada, los elementos siempre se combinan en proporciones fijas y definidas.
La importancia de esta ley radica en que proporciona una base fundamental para comprender la estequiometría, otra rama importante de la química. La estequiometría se enfoca en estudiar las relaciones cuantitativas entre los reactivos y productos en una reacción química. Al aplicar la ley de las proporciones definidas en este contexto, se pueden determinar las cantidades exactas de reactivos necesarios para obtener una determinada cantidad de producto.
Por ejemplo, consideremos la reacción de formación del agua a partir de hidrógeno y oxígeno:
2H2 + O2 → 2H2O
Según la ley de las proporciones definidas, en esta reacción se requerirán exactamente 2 moles de hidrógeno por cada mol de oxígeno para que se forme agua. Si se agregan cantidades diferentes de los reactivos, no todos los reactivos se consumirán completamente, y se formará un exceso de uno de los reactivos.
Esta relación se extiende más allá de la formación de compuestos simples y se puede aplicar en sistemas más complejos. Por ejemplo, en la síntesis de amoníaco mediante la reacción de nitrógeno e hidrógeno:
N2 + 3H2 → 2NH3
Aquí, la ley de las proporciones definidas establece que se necesitan exactamente 1 mol de nitrógeno por cada 3 moles de hidrógeno para formar 2 moles de amoníaco.
La ley de las proporciones definidas es fundamental en la estequiometría y nos permite calcular las cantidades precisas de los diferentes reactivos y productos involucrados en una reacción química. Al comprender esta ley, podemos mejorar nuestra comprensión de los procesos químicos y su aplicación en diversos campos como la industria, la medicina y la investigación.
Cuáles son algunos ejemplos y experimentos que demuestran la validez de la ley de las proporciones definidas
La ley de las proporciones definidas, propuesta por el químico francés Joseph Louis Proust en 1794, establece que los elementos combinados para formar un compuesto siempre lo hacen en proporciones fijas y definidas por masa. Esto significa que, independientemente de la cantidad de cada elemento presente en la muestra, la relación entre sus masas será constante.
Para demostrar la validez de esta ley, se han realizado numerosos experimentos a lo largo de los años. A continuación, se presentan algunos ejemplos destacados:
1. Experimento de agua y oxígeno
Uno de los experimentos más famosos se llevó a cabo con la descomposición del agua mediante electrólisis. Al pasar una corriente eléctrica a través del agua, esta se descompone en oxígeno e hidrógeno. Luego, se midieron las masas de los dos gases producidos y se observó que la relación entre ellas era siempre 8:1, lo cual cumple con la ley de las proporciones definidas.
2. Síntesis del óxido de cobre
Otro experimento importante es la síntesis del óxido de cobre. Se calienta una muestra de cobre en presencia de oxígeno, lo que provoca la formación de óxido de cobre. Al medir las masas de los elementos antes y después de la reacción, se encontró que la proporción de cobre y oxígeno siempre era 2:1, según la ley de las proporciones definidas.
3. Análisis de muestras compuestas
En el análisis químico de substancias compuestas, se han realizado numerosos experimentos en los que se descompone un compuesto y se determina la cantidad de cada elemento presente. Estos experimentos demuestran consistentemente que las proporciones entre los elementos son siempre constantes, siguiendo la ley de las proporciones definidas.
La validez de la ley de las proporciones definidas ha sido respaldada por una amplia gama de experimentos a lo largo de la historia de la química. Estos ejemplos demuestran que, sin importar las condiciones o cantidades específicas, los elementos siempre se combinan en proporciones fijas y definidas por masa cuando forman compuestos.
Qué papel desempeñó la ley de las proporciones definidas en el desarrollo de la tabla periódica y la comprensión de los elementos químicos
La ley de las proporciones definidas, también conocida como ley de las composiciones constantes, fue propuesta por primera vez por el químico francés Joseph Louis Proust en el siglo XVIII. Esta ley fue fundamental en el desarrollo de la química y jugó un papel crucial en la comprensión de los elementos químicos y el desarrollo de la tabla periódica.
La ley de las proporciones definidas establece que una sustancia química pura siempre está formada por los mismos elementos en las mismas proporciones de masa. En otras palabras, independientemente de la fuente o método de obtención de una sustancia, sus componentes se combinan en proporciones fijas y constantes.
Esta ley revolucionó la forma en que los científicos comprenden y estudian los elementos químicos. Antes de la promulgación de la ley de las proporciones definidas, existía cierta confusión sobre la composición y propiedades de las sustancias. Los químicos estaban luchando por entender de qué estaban hechas las sustancias y cómo se combinaban en reacciones químicas.
La ley de las proporciones definidas permitió a los científicos determinar con precisión la composición elemental de las sustancias químicas. Gracias a esta ley, las reacciones químicas pudieron ser explicadas y representadas de manera más precisa, sentando así las bases para el desarrollo de la química moderna.
Además, la ley de las proporciones definidas también condujo al descubrimiento de elementos químicos nuevos. Al estudiar las proporciones en las que los elementos se combinan, los científicos pudieron identificar y aislar nuevos elementos químicos. Esto fue especialmente importante en la realización de experimentos para determinar las masas atómicas relativas de los elementos.
En última instancia, la ley de las proporciones definidas allanó el camino para la creación de la tabla periódica de los elementos. Al estudiar sistemáticamente la composición química de diferentes sustancias y determinar sus proporciones, los científicos pudieron clasificar los elementos en función de sus propiedades y comportamiento químico. La tabla periódica se convirtió en una herramienta fundamental para organizar y comprender los elementos químicos, proporcionando una base sólida para el avance de la química y otras disciplinas relacionadas.
La ley de las proporciones definidas desempeñó un papel crucial en el desarrollo de la química moderna y en la comprensión de los elementos químicos. Esta ley permitió a los científicos determinar con precisión las composiciones químicas y sentó las bases para la creación de la tabla periódica. Hoy en día, esta ley sigue siendo fundamental en la enseñanza y estudio de la química, y su descubrimiento continúa asombrando y revolucionando nuestro conocimiento del mundo de los elementos.
Qué avances científicos y tecnológicos han resultado de la aplicación de la ley de las proporciones definidas
La ley de las proporciones definidas, también conocida como ley de Dalton, es uno de los pilares fundamentales de la química moderna. Fue propuesta por el científico británico John Dalton en el siglo XIX y revolucionó nuestra comprensión de cómo los elementos se combinan para formar compuestos químicos.
Esta ley establece que los elementos químicos se combinan en proporciones fijas y definidas para formar compuestos. En otras palabras, la composición de un compuesto químico siempre es constante, independientemente de cómo se haya formado.
Gracias a la aplicación de la ley de las proporciones definidas, se han logrado importantes avances científicos y tecnológicos en diversos campos:
- Síntesis de nuevos materiales: La comprensión de las proporciones definidas ha permitido a los científicos sintetizar una amplia variedad de compuestos químicos, desde nuevos polímeros y plásticos hasta materiales superconductores y nanomateriales avanzados. Estos nuevos materiales tienen aplicaciones en industrias tan diversas como la electrónica, la medicina y la energía.
- Desarrollo de medicamentos: La ley de las proporciones definidas ha sido fundamental en la síntesis de medicamentos y fármacos. Comprender las proporciones exactas de los ingredientes activos en un medicamento es crucial para garantizar su eficacia y seguridad. Además, esta ley ha permitido el desarrollo de técnicas de fabricación más precisas y eficientes en la industria farmacéutica.
- Avances en la industria alimentaria: Gracias a la ley de las proporciones definidas, se ha podido mejorar el procesamiento de alimentos y desarrollar nuevos productos con composiciones precisas. Esto incluye desde aditivos alimentarios seguros y efectivos hasta técnicas de conservación más eficientes que garantizan la calidad y seguridad de los alimentos.
La aplicación de la ley de las proporciones definidas ha tenido un impacto significativo en la ciencia y la tecnología. Su comprensión nos ha permitido avanzar en la síntesis de nuevos materiales, el desarrollo de medicamentos más eficaces y seguros, y la mejora de la industria alimentaria. No cabe duda de que esta ley continúa desempeñando un papel crucial en el avance de la química y sus aplicaciones en diversos campos.
Preguntas frecuentes (FAQ)
1. ¿Quién propuso la ley de las proporciones definidas en química?
José Luis Gay-Lussac.
2. ¿Cuál es la fórmula molecular del agua?
H2O.
3. ¿Qué es la tabla periódica de los elementos?
Es una organización de los elementos químicos según su número atómico y propiedades.
4. ¿Qué es la densidad en química?
Es la relación entre la masa de un objeto y su volumen.
5. ¿Cuántos átomos hay en una molécula de dióxido de carbono (CO2)?
Tres átomos: uno de carbono y dos de oxígeno.
Deja una respuesta
Entradas relacionadas