Elementos Representativos de la Tabla Periódica: Descubre los Secretos y Propiedades Fascinantes de los Elementos para Triunfar en Química
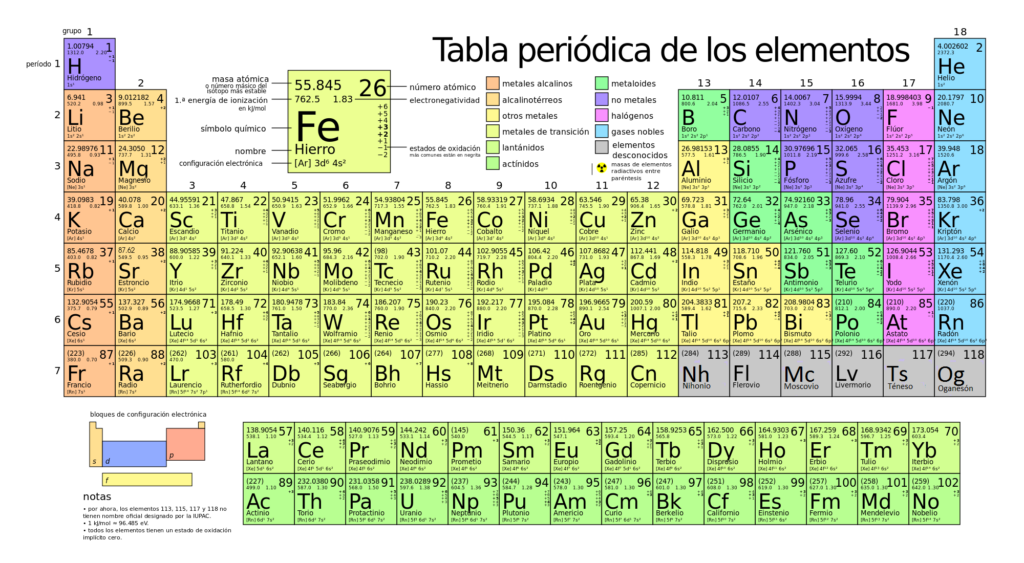
La tabla periódica es una herramienta fundamental en el estudio de la química, ya que nos permite entender la estructura y las propiedades de los elementos químicos. En ella, podemos clasificar los elementos en grupos y periodos, y aprender sobre sus características y comportamientos. Entre estos elementos, encontramos los llamados "elementos representativos", que ocupan las columnas 1, 2 y de 13 a 18 de la tabla periódica.
Exploraremos los secretos y propiedades fascinantes de los elementos representativos de la tabla periódica. Descubriremos cómo se organizan en la tabla y qué características los hacen únicos. Además, veremos ejemplos concretos de algunos de estos elementos y su importancia en nuestra vida cotidiana. ¡Prepárate para adentrarte en el maravilloso mundo de los elementos químicos!
- Qué son los elementos representativos de la tabla periódica
- Cuál es la importancia de los elementos representativos en química
- Cuántos grupos conforman los elementos representativos y cuáles son
- Qué propiedades físicas distinguen a los elementos representativos
- Cuáles son las propiedades químicas más destacadas de los elementos representativos
- Cómo se clasifican los elementos representativos según su reactividad
- Cuáles son algunos ejemplos de elementos representativos y sus usos comunes
- Cuál es la relación entre la posición de los elementos representativos en la tabla periódica y sus propiedades
- Cuál es la relación entre la posición de los elementos representativos en la tabla periódica y sus propiedades
- Cuál ha sido el impacto de los elementos representativos en la industria y la tecnología
- Cuáles son algunas curiosidades o datos interesantes sobre los elementos representativos que quizás no conozcas
-
Preguntas frecuentes (FAQ)
- 1. ¿Cómo se clasifican los elementos representativos en la tabla periódica?
- 2. ¿Cuáles son las propiedades más características de los elementos representativos?
- 3. ¿Cuál es el estado de oxidación más común para los elementos representativos?
- 4. ¿Cuál es el elemento representativo más abundante en la Tierra?
- 5. ¿Qué diferencias hay entre los elementos representativos y los elementos de transición?
Qué son los elementos representativos de la tabla periódica
Los elementos representativos de la tabla periódica son aquellos situados en los grupos 1, 2 y del 13 al 18. Estos elementos son conocidos por su disposición ordenada y por su participación activa en las reacciones químicas.
La clasificación de los elementos como representativos se basa en su configuración electrónica externa y en su reactividad química. Los elementos representativos tienen esta clasificación debido a que su última capa (también conocida como capa de valencia) contiene electrones que pueden participar en enlaces químicos y formar compuestos estables.
Grupos de los elementos representativos
Existen varios grupos dentro de los elementos representativos:
Grupo 1:Conocidos como metales alcalinos, estos elementos incluyen el hidrógeno (H), litio (Li), sodio (Na), potasio (K), entre otros. Tienen un solo electrón en la capa de valencia y son altamente reactivos.Grupo 2:También conocidos como metales alcalinotérreos, incluyen el berilio (Be), magnesio (Mg), calcio (Ca), entre otros. Estos elementos tienen dos electrones en la capa de valencia y tienden a formar compuestos iónicos.Grupos del 13 al 18:Estos grupos comprenden una amplia gama de elementos con diferentes propiedades químicas. Incluyen los grupos del boro (B) al argón (Ar). Los elementos de estos grupos pueden ser metales, no metales o metaloides, y su reactividad varía ampliamente.
Los elementos representativos juegan un papel fundamental en la química debido a su capacidad para formar compuestos y participar en reacciones químicas importantes. Estos elementos son ampliamente utilizados en diversas industrias, desde la fabricación de materiales hasta la producción de productos químicos esenciales.
Los elementos representativos de la tabla periódica son aquellos situados en los grupos 1, 2 y del 13 al 18. Estos elementos tienen configuraciones electrónicas externas que les permiten participar en enlaces químicos y formar compuestos estables. Los grupos 1 y 2 son conocidos como metales alcalinos y alcalinotérreos, respectivamente, mientras que los grupos del 13 al 18 incluyen una variedad de elementos con diferentes propiedades químicas.
Cuál es la importancia de los elementos representativos en química
Los elementos representativos desempeñan un papel fundamental en el estudio de la química. Estos elementos son clave para comprender los fundamentos y las propiedades de la materia, ya que pertenecen a diferentes grupos de la tabla periódica y presentan características únicas.
En primer lugar, los elementos representativos abarcan la mayoría de la tabla periódica y se encuentran agrupados en tres categorías: los metales alcalinos, los metales alcalinotérreos y los elementos del grupo del boro al grupo del nitrógeno (también conocidos como grupos 13-17).
1. Metales alcalinos
Los metales alcalinos son los elementos del grupo 1 de la tabla periódica, como el litio, sodio, potasio, entre otros. Estos elementos son altamente reactivos debido a su baja energía de ionización. Además, poseen una valencia de +1, lo que significa que tienden a perder un electrón para alcanzar la configuración electrónica estable del gas noble más cercano. Los metales alcalinos son conocidos por ser extremadamente reactivos con el agua, formando hidróxidos alcalinos y liberando hidrógeno.
2. Metales alcalinotérreos
Los metales alcalinotérreos se encuentran en el grupo 2 de la tabla periódica e incluyen elementos como el magnesio, calcio y bario. Al igual que los metales alcalinos, tienen una alta reactividad, pero su energía de ionización es mayor debido a su configuración electrónica. Los metales alcalinotérreos tienen una valencia de +2 y también tienden a perder electrones para alcanzar la configuración del gas noble más cercano. Estos elementos son esenciales para la formación de huesos y tejidos en los seres vivos, así como para muchas reacciones químicas importantes.
3. Elementos del grupo del boro al grupo del nitrógeno
Los elementos del grupo del boro al grupo del nitrógeno abarcan el grupo 13 al grupo 17 de la tabla periódica, como el carbono, silicio, fósforo, entre otros. Estos elementos son conocidos por su alta versatilidad y capacidad de formar compuestos covalentes estables. Tienen diferentes valencias, lo que les permite participar en una amplia gama de reacciones químicas. Por ejemplo, el carbono es fundamental para la vida debido a su capacidad para formar enlaces covalentes múltiples y estructuras complejas, como el ADN. El nitrógeno es esencial para la síntesis de proteínas y forma parte de muchas biomoléculas esenciales para los seres vivos.
Los elementos representativos desempeñan un rol primordial en el estudio de la química debido a sus propiedades y comportamientos únicos. Comprender las características de estos elementos nos permite entender mejor la estructura y el funcionamiento de la materia, así como hacer predicciones sobre las reacciones químicas y su uso en diversos campos como la industria, la medicina y la agricultura.
Cuántos grupos conforman los elementos representativos y cuáles son
La tabla periódica se divide en diferentes grupos o familias de elementos, los cuales comparten características similares. En el caso de los elementos representativos, también conocidos como elementos principales, conforman la gran mayoría de la tabla periódica y se ubican en los grupos 1, 2 y del 13 al 18.
Grupo 1: Metales alcalinos
El grupo 1 de la tabla periódica está formado por los metales alcalinos. Estos elementos incluyen el litio (Li), el sodio (Na), el potasio (K), el rubidio (Rb), el cesio (Cs) y el francio (Fr). Caracterizados por ser altamente reactivos y suaves al tacto, los metales alcalinos son extremadamente importantes en la industria química y se utilizan en diversas aplicaciones, desde baterías hasta productos de limpieza.
Grupo 2: Metales alcalinotérreos
El grupo 2 de la tabla periódica está compuesto por los metales alcalinotérreos. Estos elementos incluyen el berilio (Be), el magnesio (Mg), el calcio (Ca), el estroncio (Sr), el bario (Ba) y el radio (Ra). Los metales alcalinotérreos poseen propiedades similares a los metales alcalinos, aunque son menos reactivos. Se encuentran en muchas sustancias y materiales cotidianos, como los huesos y los dientes, y son esenciales para el funcionamiento de organismos vivos.
Grupos 13 al 18: Elementos p
Los grupos 13 al 18 de la tabla periódica están conformados por los elementos pertenecientes a la serie p o elementos representativos. Estas familias incluyen elementos como el boro (B), el carbono (C), el nitrógeno (N), el oxígeno (O), el flúor (F), el fósforo (P), el azufre (S), el cloro (Cl) y el argón (Ar), entre otros. Los elementos p abarcan una gran variedad de propiedades y características, desde no metales altamente reactivos hasta gases nobles inertes. Son fundamentales en muchos procesos químicos, tanto naturales como sintéticos, y se utilizan en numerosas aplicaciones tecnológicas y industriales.
Qué propiedades físicas distinguen a los elementos representativos
Los elementos representativos de la tabla periódica son aquellos que pertenecen a los grupos 1, 2 y 13-18. Estos grupos son también conocidos como los "grupos principales" o "grupos A".
Estos elementos se distinguen por tener una configuración electrónica externa completa en su capa de valencia, lo que les confiere propiedades físicas y químicas particulares.
Metaloides
Los elementos del grupo 13-16 son conocidos como metaloides. Estos elementos poseen características tanto de los metales como de los no metales. Son semiconductores, lo que significa que tienen una conductividad eléctrica intermedia entre los metales (conductores) y los no metales (aislantes). Los metaloides incluyen al boro, silicio, germanio, arsénico, antimonio, telurio y polonio.
No metales
Los elementos del grupo 17 y 18 son conocidos como no metales. Estos elementos generalmente son malos conductores de calor y electricidad, tienen puntos de fusión y ebullición bajos y presentan formas moleculares gaseosas, líquidas o sólidas frágiles en condiciones estándar. Algunos ejemplos de no metales son el oxígeno, nitrógeno, flúor, cloro, yodo y helio.
Alcalinos y alcalinotérreos
Los elementos del grupo 1 y 2 son conocidos como alcalinos y alcalinotérreos respectivamente. Los alcalinos, como el litio, sodio y potasio, son elementos muy reactivos debido a su baja energía de ionización. Mientras que los alcalinotérreos, como el calcio, magnesio y berilio, también son reactivos, pero en menor medida que los alcalinos. Ambos grupos son metales blandos y tienen una mayor tendencia a formar compuestos iónicos.
Los elementos representativos de la tabla periódica exhiben una variedad de propiedades físicas fascinantes. Desde los metaloides que actúan como semiconductores hasta los no metales que presentan formas moleculares frágiles, cada grupo tiene sus características únicas. Comprender estas propiedades es esencial para triunfar en química y utilizar los elementos de manera eficiente en diversos contextos científicos e industriales.
Cuáles son las propiedades químicas más destacadas de los elementos representativos
Los elementos representativos son aquellos que se encuentran en los grupos 1, 2 y 13-18 de la tabla periódica. Estos elementos poseen una gran importancia en la química, ya que exhiben propiedades químicas únicas y fascinantes.
Propiedades físicas y químicas de los elementos del grupo 1 (metales alcalinos)
Los elementos del grupo 1, también conocidos como metales alcalinos, son extremadamente reactivos debido a su configuración electrónica. Su valencia de +1 los hace altamente propensos a perder un electrón y formar cationes monopositivos. Además, poseen baja densidad y puntos de fusión relativamente bajos.
Litio (Li): Es el elemento más ligero de este grupo y tiene una alta reactividad. Se utiliza en baterías y aleaciones ligeras.Sodio (Na): Presente en la sal común, tiene aplicaciones en la industria química y alimentaria.Potasio (K): Es esencial para los seres vivos y se utiliza en fertilizantes y explosivos.Rubidio (Rb): Tiene aplicaciones en la ciencia de materiales y procesos industriales.Cesio (Cs): Es utilizado en dispositivos fotoeléctricos y en relojes atómicos.Francio (Fr): Es uno de los elementos más raros y radioactivos. Debido a su corta vida media, solo se encuentra en trazas en la naturaleza.
Propiedades físicas y químicas de los elementos del grupo 2 (metales alcalinotérreos)
Los elementos del grupo 2, también conocidos como metales alcalinotérreos, son menos reactivos que los metales alcalinos pero aún así exhiben una reactividad significativa. Su valencia de +2 los hace propensos a perder dos electrones y formar cationes bipositivos.
Berilio (Be): Es un metal de baja densidad utilizado en aleaciones y materiales estructurales.Magnesio (Mg): Es el quinto elemento más abundante en la Tierra y se utiliza en muchas aplicaciones industriales.Calcio (Ca): Es esencial para los organismos vivos y es importante en la construcción ósea.Estroncio (Sr): Se utiliza en fuegos artificiales y en la fabricación de vidrios especiales.Radio (Ra): Todos los isótopos de radio son radiactivos y pueden causar daño en los tejidos vivos debido a su alta radiactividad.
Propiedades físicas y químicas de los elementos de los grupos 13-18 (metales representativos y no metales)
Los elementos de los grupos 13-18 son una mezcla de metales, metaloides y no metales. Estos elementos exhiben una amplia variedad de propiedades físicas y químicas.
Aluminio (Al): Es un metal liviano y resistente que se utiliza en la industria aeronáutica y en la construcción.Fósforo (P): Es esencial para los organismos vivos y se utiliza en fertilizantes y, en forma blanca, en palos de fósforo.Azufre (S): Se encuentra en muchos compuestos y tiene aplicaciones en la industria química.Cloro (Cl): Es un gas altamente reactivo y esencial para muchas reacciones químicas y para el tratamiento del agua.Gases nobles: Los elementos del grupo 18, como el helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn), son conocidos como gases nobles por su baja reactividad.
Los elementos representativos de la tabla periódica tienen propiedades químicas únicas y fascinantes que los hacen elementos clave en la química y en diversas aplicaciones tecnológicas e industriales.
Cómo se clasifican los elementos representativos según su reactividad
Los elementos representativos se clasifican según su reactividad en tres grupos principales: los metales alcalinos, los metales alcalinotérreos y los halógenos.
Metales Alcalinos
Los metales alcalinos se encuentran en el grupo 1 de la tabla periódica y son los elementos más reactivos. Estos incluyen al litio (Li), el sodio (Na), el potasio (K), el rubidio (Rb), el cesio (Cs) y el francio (Fr). Tienen una configuración electrónica de un solo electrón en su capa externa, lo que los hace muy dispuestos a perder ese electrón para alcanzar una configuración más estable. Esto los convierte en poderosos agentes reductores y les permite formar compuestos altamente iónicos con elementos no metálicos.
Metales Alcalinotérreos
Los metales alcalinotérreos se encuentran en el grupo 2 de la tabla periódica. Estos son el berilio (Be), el magnesio (Mg), el calcio (Ca), el estroncio (Sr), el bario (Ba) y el radio (Ra). Aunque son menos reactivos que los metales alcalinos, todavía tienden a perder dos electrones de su capa externa para lograr una configuración más estable. Como resultado, también son agentes reductores fuertes, aunque no tanto como los metales alcalinos. Los metales alcalinotérreos son comúnmente encontrados en minerales y son esenciales para muchos procesos biológicos.
Halógenos
Los halógenos se encuentran en el grupo 17 de la tabla periódica y son los elementos más electronegativos. Estos incluyen al flúor (F), el cloro (Cl), el bromo (Br), el yodo (I) y el astato (At). Los halógenos tienen una configuración electrónica cercana a alcanzar una configuración estable mediante la ganancia de un electrón adicional para completar su capa externa. Por esta razón, tienden a formar compuestos iónicos con metales alcalinos y alcalinotérreos. Además, los halógenos son altamente reactivos y pueden ser utilizados como desinfectantes, agentes oxidantes y en industrias químicas para la producción de diversos productos.
Cuáles son algunos ejemplos de elementos representativos y sus usos comunes
Los elementos representativos, también conocidos como elementos del grupo principal, son aquellos ubicados en los grupos 1 y 2 (elementos del bloque s) y en los grupos 13 al 18 (elementos del bloque p) de la tabla periódica. A continuación, te presentaremos algunos ejemplos de elementos representativos y sus usos comunes:
Grupo 1: Metales alcalinos
- Litio (Li): Se utiliza en baterías recargables, aleaciones de aluminio-litio y en medicamentos para tratar trastornos bipolares.
- Sodio (Na): Es esencial para la transmisión de impulsos nerviosos y se utiliza en la fabricación de productos químicos, vidrio y detergentes.
- Potasio (K): Contribuye a mantener el equilibrio hídrico y eléctrico del organismo. También se utiliza en fertilizantes, explosivos y en la industria del vidrio.
Grupo 2: Metales alcalinotérreos
- Magnesio (Mg): Se utiliza en aleaciones de metales, productos farmacéuticos, pirotecnia y en la industria aeroespacial.
- Calcio (Ca): Es fundamental para la formación de huesos y dientes. Además, se utiliza en la producción de acero, cemento, lácteos fortificados y otros alimentos.
- Bario (Ba): Se emplea en la industria del petróleo y gas para aumentar la densidad de los lodos de perforación. También se utiliza en la producción de fuegos artificiales y vidrio.
Grupo 13: Familia del boro
- Boro (B): Se utiliza en la fabricación de vidrios especiales, productos químicos, pesticidas y como absorbente de neutrones en reactores nucleares.
- Aluminio (Al): Es ampliamente utilizado en la construcción de aviones, automóviles, ventanas, latas de bebidas y como conductor de electricidad.
- Gallio (Ga): Se usa en circuitos integrados, paneles solares, espejos y láseres debido a sus propiedades semiconductores.
Grupo 14: Familia del carbono
- Carbono (C): Es un elemento fundamental para la vida ya que forma parte de todas las moléculas orgánicas. También se utiliza en la fabricación de acero y otros materiales.
- Silicio (Si): Es ampliamente utilizado en la producción de chips de computadoras, paneles solares, cristales y cerámicas.
- Estaño (Sn): Se utiliza en la producción de latas de alimentos, soldaduras, recubrimientos metálicos y aleaciones.
Estos son solo algunos ejemplos de elementos representativos y sus usos comunes. La tabla periódica está llena de elementos fascinantes con propiedades únicas que han contribuido significativamente en diferentes áreas de la ciencia, la tecnología y la industria.
Cuál es la relación entre la posición de los elementos representativos en la tabla periódica y sus propiedades
Cuál es la relación entre la posición de los elementos representativos en la tabla periódica y sus propiedades
La tabla periódica de los elementos es una herramienta fundamental en química, ya que nos permite organizar y comprender las propiedades de los diferentes elementos. Los elementos representativos, también conocidos como elementos principales o elementos del grupo A, constituyen la mayoría de los elementos en la tabla periódica.
La posición de los elementos representativos en la tabla periódica puede proporcionarnos valiosas pistas sobre sus propiedades y comportamiento químico. A medida que nos desplazamos de izquierda a derecha a lo largo de un período (fila) en la tabla periódica, podemos observar un patrón en la variación de propiedades como el radio atómico, la electronegatividad y la energía de ionización.
Por ejemplo, en un mismo período, el radio atómico disminuye a medida que se avanza hacia la derecha. Esto se debe a que a medida que vamos agregando electrones a la misma capa principal, la carga nuclear efectiva (la atracción ejercida por el núcleo sobre los electrones externos) aumenta, lo que contrae el tamaño del átomo.
En contraste, a medida que nos movemos de arriba abajo a través de un grupo (columna) en la tabla periódica, encontramos una tendencia opuesta en el radio atómico. El radio atómico tiende a aumentar a medida que bajamos en un grupo. Esto se debe a que se están agregando nuevas capas electrónicas a medida que descendemos en el grupo, lo que resulta en un aumento del tamaño del átomo.
Otra propiedad que varía de manera predecible en los elementos representativos es la electronegatividad, que se refiere a la capacidad de un átomo para atraer electrones hacia sí mismo. A medida que nos desplazamos de izquierda a derecha a lo largo de un período en la tabla periódica, la electronegatividad tiende a aumentar. Esto se debe a que los átomos en la parte derecha de la tabla periódica tienen una mayor carga nuclear efectiva y una menor pantalla de electrones internos, lo que les permite atraer más fuertemente a los electrones externos de otros átomos.
Por el contrario, a medida que descendemos en un grupo en la tabla periódica, la electronegatividad tiende a disminuir. Esto se debe a que la distancia entre el núcleo y los electrones en capas exteriores aumenta a medida que bajamos en un grupo, lo que reduce la atracción entre el núcleo y los electrones exteriores.
- Estos patrones en la variación de propiedades permiten predecir el comportamiento químico de los elementos representativos en la tabla periódica.
- Además de las propiedades mencionadas, la posición de los elementos representativos también puede proporcionar información sobre su reactividad química, capacidad para formar enlaces y muchas otras características importantes.
La posición de los elementos representativos en la tabla periódica está estrechamente relacionada con sus propiedades y comportamiento químico. La tabla periódica es una herramienta invaluable para los químicos, ya que les permite comprender y predecir el comportamiento de los elementos en función de su posición en la tabla.
Cuál ha sido el impacto de los elementos representativos en la industria y la tecnología
Los elementos representativos de la tabla periódica han tenido un impacto significativo en la industria y la tecnología. Estos elementos se encuentran en los grupos 1, 2 y 13 al 18 de la tabla periódica y son conocidos por su alta reactividad y propiedades químicas distintivas.
Uno de los elementos representativos más importantes es el hidrógeno (H), que es utilizado en diversas aplicaciones industriales y tecnológicas. El hidrógeno es un componente clave en la producción de amoníaco, que a su vez se utiliza para fabricar fertilizantes. Además, el hidrógeno es utilizado como combustible en celdas de combustible, lo que ha llevado al desarrollo de tecnologías de energía limpia y sostenible.
Otro elemento representativo significativo es el oxígeno (O), que es fundamental para la vida y tiene una amplia gama de aplicaciones industriales. El oxígeno se utiliza en la producción de acero, ya que es necesario para oxidar impurezas y mejorar la calidad del metal. También se utiliza en la industria química para la síntesis de otros compuestos y en aplicaciones médicas para la terapia de oxígeno.
El grupo de los halógenos, que incluye elementos como el flúor (F), cloro (Cl), bromo (Br) y yodo (I), también ha tenido un impacto considerable en la industria y la tecnología. Estos elementos son altamente reactivos y se utilizan en la producción de productos químicos, como blanqueadores, desinfectantes y pesticidas. Además, el yodo se utiliza en aplicaciones médicas, como desinfectantes y contrastes radiológicos.
Los elementos representativos del grupo de los alcalinos (como el sodio (Na) y el potasio (K)) y los alcalinotérreos (como el calcio (Ca) y el magnesio (Mg)) también son ampliamente utilizados en la industria y la tecnología. El sodio se utiliza en la producción de vidrios y detergentes, mientras que el calcio y el magnesio son esenciales para la construcción y la metalurgia.
En general, los elementos representativos de la tabla periódica tienen propiedades químicas únicas que los hacen fundamentales para numerosas aplicaciones industriales y tecnológicas. Su reactividad y versatilidad los convierten en componentes clave en una amplia gama de procesos y productos que impactan nuestra vida diaria.
Cuáles son algunas curiosidades o datos interesantes sobre los elementos representativos que quizás no conozcas
Los elementos representativos son aquellos que se encuentran en los grupos 1, 2 y 13 al 18 de la tabla periódica. Estos elementos tienen características particulares que los distinguen y los hacen especialmente importantes en el estudio de la química. A continuación, te presentamos algunas curiosidades o datos interesantes sobre estos elementos:
1. Grupos 1 y 2: Metales Alcalinos y Alcalinotérreos
Los metales alcalinos del grupo 1, como el sodio y el potasio, son tan reactivos que nunca se encuentran en forma pura en la naturaleza. Por otro lado, los metales alcalinotérreos del grupo 2, como el calcio y el magnesio, son menos reactivos pero aún así son indispensables para la vida, ya que forman parte de los componentes esenciales de nuestros cuerpos.
2. Grupo 17: Halógenos
Los halógenos, como el cloro y el flúor, son altamente reactivos y se encuentran en estado gaseoso a temperatura ambiente. Estos elementos son utilizados en muchas aplicaciones cotidianas, desde la purificación del agua hasta la producción de productos químicos importantes como el PVC. Además, tienen una gran capacidad para formar compuestos con otros elementos, lo que los convierte en excelentes agentes oxidantes.
3. Grupo 18: Gases Nobles
Los gases nobles, como el helio y el argón, son muy estables y poco reactivos. Esta característica los hace ideales para uso en lámparas y luces de neón, ya que emiten luz brillante cuando son excitados eléctricamente. Además, su falta de reactividad los convierte en elementos utilizados en aplicaciones de alta tecnología, como en la industria aeroespacial y la medicina nuclear.
4. Grupos 13 al 16
Los elementos de estos grupos, como el carbono y el silicio, tienen propiedades mixtas y pueden formar compuestos con una amplia gama de propiedades químicas. El carbono es especialmente notable por su capacidad para formar enlaces covalentes múltiples y su versatilidad para formar compuestos complejos, incluyendo aquellos que conforman la base de la vida en la Tierra.
Los elementos representativos nos muestran una variedad de propiedades y características fascinantes que los hacen indispensables en la química y en muchos aspectos de nuestras vidas. Ya sea su reactividad extrema, su estabilidad o su capacidad para formar compuestos únicos, estos elementos juegan un papel clave en la ciencia y la tecnología moderna.
Preguntas frecuentes (FAQ)
1. ¿Cómo se clasifican los elementos representativos en la tabla periódica?
Los elementos representativos se clasifican en tres grupos: Grupo 1 (Alcalinos), Grupo 2 (Alcalinotérreos) y Grupos 13 al 18 (Grupo del Boro y Grupo del Carbón).
2. ¿Cuáles son las propiedades más características de los elementos representativos?
Los elementos representativos suelen tener baja densidad, baja temperatura de ebullición y alta reactividad química.
3. ¿Cuál es el estado de oxidación más común para los elementos representativos?
Para los elementos del Grupo 1, el estado de oxidación más común es +1; para los elementos del Grupo 2, es +2; y para los elementos del Grupo del Boro, es +3.
4. ¿Cuál es el elemento representativo más abundante en la Tierra?
El oxígeno es el elemento más abundante en la Tierra, que pertenece al Grupo 16 de la tabla periódica.
5. ¿Qué diferencias hay entre los elementos representativos y los elementos de transición?
Los elementos representativos se encuentran en los grupos 1, 2 y 13 a 18, mientras que los elementos de transición se encuentran en los grupos de transición del 3 al 12. Además, los elementos de transición tienen electrones de valencia en diferentes niveles de energía.
Deja una respuesta
Entradas relacionadas