La Ley de Boyle-Mariotte: Todo lo que necesitas saber sobre la relación entre presión y volumen
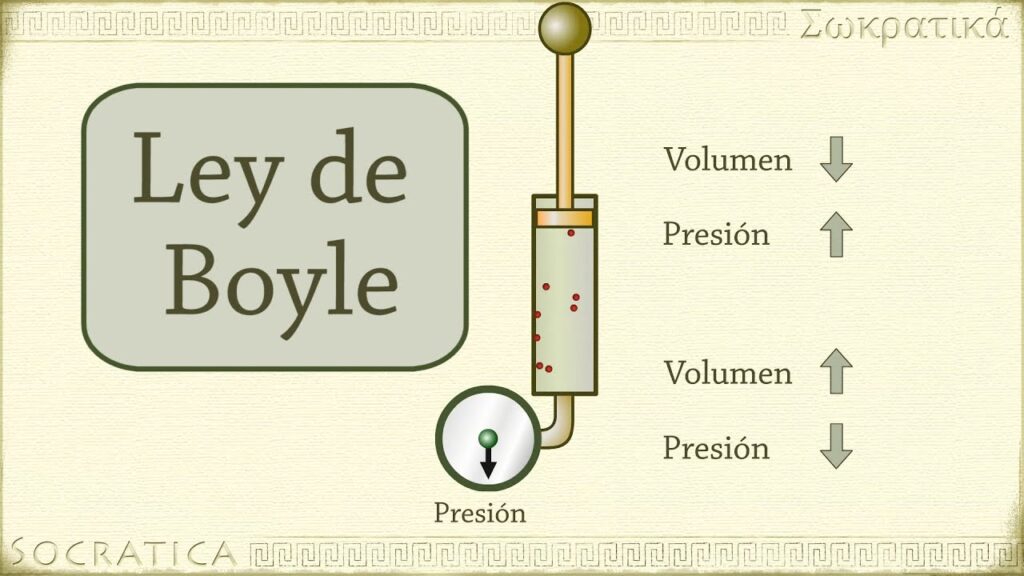
La Ley de Boyle-Mariotte es un principio fundamental en el estudio de la física y la química. Establece una relación inversamente proporcional entre la presión de un gas y su volumen en condiciones constantes de temperatura.
Exploraremos en detalle esta ley y su importancia en diversos campos científicos. Discutiremos cómo se puede aplicar y medir la Ley de Boyle-Mariotte en experimentos prácticos, así como su utilidad en la vida cotidiana. También veremos ejemplos concretos que ayudarán a comprender mejor esta relación entre presión y volumen.
- Qué es la Ley de Boyle-Mariotte
- Quiénes fueron Boyle y Mariotte y cómo descubrieron esta relación
- Cuál es la fórmula matemática de la Ley de Boyle-Mariotte
- Cómo se relaciona la presión y el volumen en un gas
- En qué situaciones se puede aplicar la Ley de Boyle-Mariotte
- Cuáles son las unidades de medida utilizadas para la presión y el volumen
- Qué experimentos se han realizado para demostrar la Ley de Boyle-Mariotte
- Cómo se utiliza la Ley de Boyle-Mariotte en la vida cotidiana
- Cuál es la importancia de la Ley de Boyle-Mariotte en la industria y la investigación científica
- Existen algunas limitaciones o excepciones a la Ley de Boyle-Mariotte
- ¿Cuál es la relación entre la temperatura y la Ley de Boyle-Mariotte?
- Se puede aplicar la Ley de Boyle-Mariotte a líquidos o sólidos
-
Preguntas frecuentes (FAQ)
- 1. ¿Cuál es la relación entre la presión y el volumen según la ley de Boyle-Mariotte?
- 2. ¿Qué unidades se utilizan para medir la presión en la ley de Boyle-Mariotte?
- 3. ¿Cómo se aplica la ley de Boyle-Mariotte en la vida cotidiana?
- 4. ¿Qué sucede con la temperatura en la ley de Boyle-Mariotte?
- 5. ¿Cuál es la importancia de la ley de Boyle-Mariotte en la ciencia?
Qué es la Ley de Boyle-Mariotte
La Ley de Boyle-Mariotte, también conocida como la Ley de Boyle, establece una relación inversamente proporcional entre la presión y el volumen de un gas a temperatura constante.
Esta ley fue formulada por Robert Boyle en 1662 y posteriormente desarrollada por Edme Mariotte en 1676. Su descubrimiento fue de gran importancia en el campo de la física y sentó las bases para el estudio de los gases.
De acuerdo con la Ley de Boyle-Mariotte, si se mantiene la temperatura constante, el producto de la presión y el volumen de un gas es siempre constante. En otras palabras, cuando la presión sobre un gas aumenta, su volumen disminuye; y viceversa, cuando la presión disminuye, el volumen aumenta.
Esta ley se puede expresar matemáticamente mediante la ecuación:
P1 * V1 = P2 * V2
- P1 representa la presión inicial del gas.
- V1 representa el volumen inicial del gas.
- P2 representa la presión final del gas.
- V2 representa el volumen final del gas.
La Ley de Boyle-Mariotte nos dice que hay una relación inversa entre la presión y el volumen de un gas a temperatura constante. Esta ley tiene aplicaciones en diversos campos como la industria, la medicina y la astronomía, entre otros.
Quiénes fueron Boyle y Mariotte y cómo descubrieron esta relación
Robert Boyle, un científico irlandés, y Edme Mariotte, un físico y matemático francés, fueron los pioneros en descubrir la relación entre la presión y el volumen de un gas. A finales del siglo XVII, ambos científicos realizaron experimentos independientes que les llevaron a formular una ley que establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión.
Estos experimentos sentaron las bases para entender cómo se comportan los gases y son considerados fundamentales en el campo de la física y la química. La ley de Boyle-Mariotte, también conocida como la ley de Boyle o simplemente ley de los gases, fue publicada por primera vez en el año 1662 por Robert Boyle en su obra "New Experiments and Observations Touching Cold".
Cómo se expresa matemáticamente la ley de Boyle-Mariotte
La ley de Boyle-Mariotte se puede expresar matemáticamente mediante la siguiente fórmula:
P1 * V1 = P2 * V2
donde P1 y V1 representan la presión y el volumen inicial, respectivamente, y P2 y V2 corresponden a la presión y volumen final.
Esta fórmula muestra que si la presión aumenta, el volumen disminuye, y si la presión disminuye, el volumen aumenta, siempre y cuando la temperatura se mantenga constante. Si se duplica la presión, el volumen se reduce a la mitad y viceversa.
Aplicaciones prácticas de la ley de Boyle-Mariotte
La ley de Boyle-Mariotte tiene numerosas aplicaciones prácticas en campos como la ingeniería, la medicina y la meteorología. Algunos ejemplos incluyen:
- Compresores de aire: se utilizan para aumentar la presión y disminuir el volumen del aire.
- Bombas de agua: funcionan bajo el principio de aumentar la presión y disminuir el volumen del líquido para su transporte.
- Inhaladores: los pacientes asmáticos utilizan dispositivos que aprovechan esta relación para administrar medicamentos en forma de aerosol.
- Vuelos en avión: la variación de presión en la cabina durante el ascenso y el descenso puede afectar los oídos de los pasajeros debido a los cambios de volumen de los gases en la cavidad timpánica.
Estas son solo algunas de las muchas aplicaciones prácticas de la ley de Boyle-Mariotte que demuestran su relevancia en nuestra vida cotidiana y en diferentes disciplinas científicas y tecnológicas.
La ley de Boyle-Mariotte establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Esta relación matemática ha sido fundamental para el desarrollo de la física y la química, y tiene aplicaciones prácticas en diversos campos de la ciencia y la tecnología.
Cuál es la fórmula matemática de la Ley de Boyle-Mariotte
La Ley de Boyle-Mariotte establece que, a temperatura constante, el volumen de una cantidad fija de gas es inversamente proporcional a la presión a la que está sometido. En términos matemáticos, esta relación se puede expresar de la siguiente manera:
P1 * V1 = P2 * V2
Donde P1 y V1 representan la presión y el volumen iniciales del gas, respectivamente, mientras que P2 y V2 representan la presión y el volumen finales luego de un cambio en las condiciones.
Cómo se relaciona la presión y el volumen en un gas
La Ley de Boyle-Mariotte es una ley fundamental en la física de los gases que establece la relación entre la presión y el volumen de un gas, siempre y cuando la temperatura y la cantidad de sustancia se mantengan constantes. Esta ley fue descubierta de manera independiente por el científico británico Robert Boyle y el científico francés Edme Mariotte en el siglo XVII.
La relación entre la presión (P) y el volumen (V) en un gas puede ser expresada matemáticamente mediante la siguiente fórmula:
P ∝ 1/V
Esta relación significa que si la presión del gas aumenta, su volumen disminuirá, y viceversa. Si mantenemos constante la temperatura y la cantidad de sustancia del gas, podemos reescribir la fórmula como:
P1 * V1 = P2 * V2
Donde P1 y V1 representan la presión y el volumen iniciales del gas, mientras que P2 y V2 representan la presión y el volumen finales luego de algún cambio.
En otras palabras, si la presión de un gas se duplica (P2 = 2 * P1), su volumen se reduce a la mitad (V2 = 1/2 * V1). Esto demuestra la naturaleza inversamente proporcional entre la presión y el volumen.
Es importante tener en cuenta que la Ley de Boyle-Mariotte solo es válida para gases ideales, es decir, gases que se comportan perfectamente de acuerdo con las leyes de la termodinámica. Sin embargo, en la práctica, muchos gases reales se comportan de manera similar a los gases ideales en ciertas condiciones.
La Ley de Boyle-Mariotte tiene numerosas aplicaciones en campos como la física, la química y la ingeniería. Por ejemplo, es utilizada para estudiar los efectos de la presión en los sistemas de aire acondicionado y refrigeración, así como en el diseño de equipos de compresión de gases.
En qué situaciones se puede aplicar la Ley de Boyle-Mariotte
La Ley de Boyle-Mariotte es una de las leyes fundamentales en la física de los gases y se aplica en diversas situaciones relacionadas con cambios en la presión y el volumen. A continuación, veremos algunas de las situaciones en las que se puede aplicar esta ley:
1. Cambios en el volumen a temperatura constante:
La Ley de Boyle-Mariotte establece que, a una temperatura constante, el volumen de una muestra de gas es inversamente proporcional a la presión ejercida sobre él. Esto significa que si aumentamos la presión sobre una muestra de gas, su volumen disminuirá y viceversa.
Este principio se aplica en muchos casos, como por ejemplo cuando se cambia la presión dentro de un neumático de un vehículo. Al aumentar la presión con una bomba de aire, el volumen del gas en el neumático disminuye, lo que contribuye a tener una mayor estabilidad y eficiencia en la conducción.
2. Cambios en la presión a volumen constante:
En esta situación, la Ley de Boyle-Mariotte se utiliza para describir cómo varía la presión de una muestra de gas cuando se modifica el volumen, manteniendo la temperatura constante. Según esta ley, si el volumen disminuye, la presión aumentará y si el volumen aumenta, la presión disminuirá.
Esto es especialmente relevante en la industria alimentaria y farmacéutica, donde se utilizan sistemas de empaque al vacío para prolongar la vida útil de productos perecederos. Al disminuir el volumen y crear un ambiente de baja presión, se reduce la proliferación de microorganismos y se mantiene la calidad del producto por más tiempo.
3. Cambios en la temperatura a presión constante:
Aunque la Ley de Boyle-Mariotte no se aplica directamente a cambios en la temperatura, es importante mencionar que esta ley solo se cumple si se mantiene constante la temperatura del gas. Si se varía la temperatura, entonces otras leyes y principios entran en juego.
Sin embargo, en caso de mantener una temperatura constante, la relación entre la presión y el volumen sigue siendo válida. Por ejemplo, en los sistemas de acondicionamiento de aire, al aumentar la temperatura en un espacio cerrado, el gas contenido en el sistema experimentará una expansión y, por lo tanto, disminuirá su presión.
La Ley de Boyle-Mariotte se aplica en situaciones en las que se modifican la presión y el volumen de una muestra de gas, ya sea a temperatura constante o a volumen constante. Comprender y aplicar esta ley es esencial en numerosos campos, desde la física y la química hasta la industria y la medicina.
Cuáles son las unidades de medida utilizadas para la presión y el volumen
Al estudiar la Ley de Boyle-Mariotte y la relación entre presión y volumen, es importante comprender las unidades de medida utilizadas para estas magnitudes.
La presión se mide comúnmente en unidades como el pascal (Pa), que es equivalente a una fuerza de un newton por metro cuadrado. También se pueden utilizar otras unidades más comunes, como el kilopascal (kPa) o la atmósfera (atm).
En cuanto al volumen, se utiliza generalmente el metro cúbico (m³) como unidad estándar. Sin embargo, pueden usarse también el litro (L) o sus submúltiplos, como el mililitro (mL).
Es importante tener en cuenta que, al realizar cálculos relacionados con la Ley de Boyle-Mariotte, es necesario utilizar las mismas unidades de medida para la presión y el volumen. Si se utilizan diferentes unidades, es necesario convertir las magnitudes mediante los factores de conversión apropiados.
Qué experimentos se han realizado para demostrar la Ley de Boyle-Mariotte
La Ley de Boyle-Mariotte, también conocida como la Ley de los Volúmenes de los Gases, establece que a temperatura constante, el volumen de un gas es inversamente proporcional a la presión ejercida sobre él. En otras palabras, si se aumenta la presión de un gas, su volumen disminuirá y viceversa.
Esta ley fue formulada por primera vez por Robert Boyle en 1662 y posteriormente desarrollada por Edme Mariotte en 1676. Para demostrar esta relación entre presión y volumen, se realizaron varios experimentos a lo largo de la historia.
Experimento de Boyle con el tubo en forma de U
Uno de los experimentos más famosos fue el realizado por Robert Boyle utilizando un tubo en forma de U, abierto en ambos extremos. Boyle introdujo mercurio en uno de los brazos del tubo hasta alcanzar una altura determinada y luego añadió más mercurio en el mismo brazo hasta que el nivel del mercurio subió en el otro brazo, comprimiendo el aire contenido dentro del tubo.
Boyle observó que al incrementar la cantidad de mercurio, la columna de aire se comprimía y el nivel del mercurio en el otro brazo subía. Por el contrario, al reducir la cantidad de mercurio, la columna de aire se expandía y el nivel del mercurio en el otro brazo descendía. Este experimento demostró de manera visual cómo la presión ejercida sobre el gas afectaba su volumen.
Experimento de manómetro
Otro experimento comúnmente utilizado para demostrar la Ley de Boyle-Mariotte es el manómetro. Un manómetro es un dispositivo que permite medir la presión ejercida sobre un gas en un recipiente cerrado.
En este experimento, se coloca un gas en un recipiente cerrado conectado a un manómetro. Luego, se modifica la presión aplicada al gas y se observa cómo esta afecta el volumen del mismo. Los resultados obtenidos confirman la relación inversa entre presión y volumen establecida por la Ley de Boyle-Mariotte.
Experimento con jeringa
Un experimento sencillo que puede realizarse para ilustrar la Ley de Boyle-Mariotte consiste en utilizar una jeringa. Se llena la jeringa con aire y se tapa el extremo para evitar que escape el gas. Al presionar la jeringa, se comprime el aire en su interior, lo que causa un aumento de la presión y una disminución del volumen. Al soltar la presión, el aire se expande nuevamente, resultando en una reducción de la presión y un aumento del volumen. Este experimento muestra de manera práctica cómo la presión y el volumen están relacionados según la Ley de Boyle-Mariotte.
Cómo se utiliza la Ley de Boyle-Mariotte en la vida cotidiana
La Ley de Boyle-Mariotte es una de las leyes fundamentales de la física que describe la relación inversa entre la presión y el volumen de un gas manteniendo una temperatura constante. Esta ley establece que a medida que la presión de un gas aumenta, su volumen disminuye, y viceversa.
Esta ley tiene muchas aplicaciones prácticas en nuestra vida cotidiana. A continuación, mencionaré algunas de las situaciones en las que se utiliza la Ley de Boyle-Mariotte:
Buceo
En el buceo, la Ley de Boyle-Mariotte es fundamental para comprender cómo los cambios de presión afectan la capacidad pulmonar de los buzos. A medida que un buzo desciende en el agua, la presión aumenta, lo que hace que el volumen de aire en sus pulmones disminuya. Es por esto que los buzos deben respirar constantemente durante sus inmersiones, para evitar la acumulación excesiva de gases y posibles lesiones pulmonares.
Gases comprimidos
La Ley de Boyle-Mariotte también se aplica en el almacenamiento y transporte de gases comprimidos, como el oxígeno medicinal y el gas propano. Estos gases se almacenan en recipientes sellados a altas presiones, lo que reduce drásticamente su volumen. Al abrir una válvula de salida, la presión disminuye y el gas se expande ocupando un mayor volumen.
Neumáticos de automóviles
Los neumáticos de los automóviles también se benefician de la Ley de Boyle-Mariotte. Cuando inflamos un neumático, aumentamos la presión interna del aire y, por lo tanto, su volumen disminuye. Esto permite que el neumático mantenga su forma adecuada, soporte el peso del vehículo y proporcione una conducción segura y eficiente.
Medición de la presión atmosférica
Además, la Ley de Boyle-Mariotte es utilizada en los barómetros, instrumentos que se utilizan para medir la presión atmosférica. Estos dispositivos aprovechan la relación entre la presión y el volumen de un gas atrapado en un tubo cerrado. Al medir la altura a la que se eleva este gas, podemos determinar la presión atmosférica en un lugar determinado.
La Ley de Boyle-Mariotte tiene numerosas aplicaciones en nuestra vida diaria, desde el buceo y la industria de los gases comprimidos, hasta el mantenimiento adecuado de los neumáticos de nuestros vehículos y la medición de la presión atmosférica. Comprender esta ley nos ayuda a comprender mejor cómo funcionan los gases y cómo interactúan con su entorno.
Cuál es la importancia de la Ley de Boyle-Mariotte en la industria y la investigación científica
La Ley de Boyle-Mariotte, también conocida como la Ley de Boyle o la Ley de Mariotte, es un principio fundamental en la física que describe la relación inversa entre la presión y el volumen de un gas a temperatura constante. Esta ley fue formulada por primera vez por el científico Robert Boyle en 1662, y posteriormente ampliada por Edme Mariotte en 1676.
La importancia de la Ley de Boyle-Mariotte radica en su aplicación en numerosos campos, tanto en la industria como en la investigación científica. A continuación, veremos algunas de las áreas en las que esta ley desempeña un papel crucial:
Industria química y farmacéutica
En la industria química y farmacéutica, la Ley de Boyle-Mariotte se utiliza para controlar y regular la presión en sistemas cerrados. Esto permite la fabricación eficiente de productos químicos y farmacéuticos, así como la manipulación segura de sustancias peligrosas. Por ejemplo, los compresores de aire utilizados en muchas plantas industriales funcionan según los principios de esta ley para comprimir gases y aumentar su presión para diversos fines de procesamiento.
Campo médico y bioquímico
En el campo médico y bioquímico, la Ley de Boyle-Mariotte se aplica en el diseño de dispositivos y equipos que monitorean y regulan la presión dentro del cuerpo humano. Por ejemplo, los respiradores artificiales utilizados en cuidados intensivos trabajan según los principios de esta ley para suministrar aire a los pulmones de los pacientes con la presión adecuada. Además, en la investigación bioquímica, esta ley es fundamental para el estudio de fenómenos como la difusión de gases a través de las membranas celulares.
Procesos de refrigeración y climatización
La Ley de Boyle-Mariotte también es esencial en los procesos de refrigeración y climatización. La compresión y expansión de gases en refrigeradores y aire acondicionado se basa en esta ley para producir enfriamiento. Por ejemplo, cuando un gas se comprime, su presión aumenta y su temperatura también aumenta. Luego, al expandirse nuevamente, su temperatura disminuye debido a la caída en la presión. Esta variación en la presión y el volumen permite que el refrigerante absorba calor del entorno y proporcione aire frío en los sistemas de climatización.
Investigación científica y estudios de gases
En la investigación científica, la Ley de Boyle-Mariotte tiene una amplia aplicabilidad en diversos experimentos y estudios que involucran gases. Desde la determinación de densidades y masas moleculares hasta la medición de propiedades físicas y químicas, esta ley proporciona una base fundamental para la comprensión y el análisis de los comportamientos de los gases en diversas condiciones. Además, esta ley es una parte integral de la ley universal de los gases ideales, que describe el comportamiento general de los gases bajo ciertas suposiciones.
Dada su amplia aplicación y relevancia en numerosos campos, la Ley de Boyle-Mariotte es una herramienta invaluable en la comprensión y predicción de los comportamientos de los gases. Tanto en la industria como en la investigación científica, esta ley ha sentado las bases para el desarrollo de tecnologías y avances que mejoran nuestra vida diaria.
Existen algunas limitaciones o excepciones a la Ley de Boyle-Mariotte
A pesar de ser una ley fundamental en la física de los gases, la Ley de Boyle-Mariotte tiene algunas limitaciones y excepciones que deben tenerse en cuenta al aplicarla en diferentes situaciones.
1. Gases ideales vs. Gases reales
La Ley de Boyle-Mariotte se basa en el supuesto de que los gases son ideales, es decir, no tienen fuerzas intermoleculares o volumen propio. En la realidad, la mayoría de los gases no cumplen completamente con estas condiciones ideales. A altas presiones y bajas temperaturas, las fuerzas intermoleculares se vuelven significativas y pueden afectar la relación entre presión y volumen.
Además, los gases reales tienen un volumen propio que debe ser tenido en cuenta en ciertos casos. Cuando la presión es extremadamente alta y el volumen del gas es reducido, el volumen ocupado por las moléculas se vuelve relevante y puede alterar la relación entre presión y volumen.
2. Cambios de estado
Otra excepción a la Ley de Boyle-Mariotte ocurre cuando el gas experimenta un cambio de estado, como la condensación o evaporación. Durante estos cambios de fase, la relación entre presión y volumen puede no seguir directamente la ley debido a las variaciones en la energía interna del sistema.
3. Situaciones no isotérmicas
La Ley de Boyle-Mariotte asume que la temperatura del gas permanece constante durante los cambios de presión y volumen. Sin embargo, en situaciones reales, donde la temperatura varía, la relación entre presión y volumen puede no ser tan simple. En estos casos, es necesario utilizar ecuaciones más complejas que consideren los efectos de la temperatura.
Aunque la Ley de Boyle-Mariotte es una herramienta útil y ampliamente aplicable para describir la relación entre presión y volumen en los gases ideales, existen limitaciones y excepciones que deben tenerse en cuenta en situaciones donde los gases no cumplen todas las condiciones ideales o se producen cambios de estado o variaciones de temperatura.
¿Cuál es la relación entre la temperatura y la Ley de Boyle-Mariotte?
La Ley de Boyle-Mariotte establece que a temperatura constante, el volumen de un gas es inversamente proporcional a la presión aplicada sobre él. Esto significa que si se aumenta la presión en un gas a temperatura constante, su volumen disminuirá, y viceversa.
Esta relación entre la presión y el volumen se puede explicar mediante la teoría cinética de los gases. Según esta teoría, los gases están compuestos por partículas en constante movimiento y colisionando entre sí y contra las paredes del recipiente que los contiene. Cuando se aumenta la presión sobre el gas, estas colisiones se vuelven más frecuentes y generan una mayor fuerza en las paredes del recipiente, lo cual reduce su volumen.
Por otro lado, si se disminuye la presión sobre el gas, las colisiones son menos frecuentes y la fuerza ejercida sobre las paredes del recipiente disminuye, permitiendo que el gas se expanda y ocupe un mayor volumen.
Es importante destacar que esta relación solo se cumple si la temperatura se mantiene constante. Si se modifica la temperatura de un gas, su comportamiento puede seguir la Ley de Charles (relación entre volumen y temperatura) o la Ley de Gay-Lussac (relación entre presión y temperatura).
La Ley de Boyle-Mariotte establece que a temperatura constante, existe una relación inversa entre la presión y el volumen de un gas. Esta relación puede ser explicada mediante la teoría cinética de los gases, donde las colisiones entre las partículas del gas y las paredes del recipiente generan una mayor fuerza a medida que se aumenta la presión, lo cual reduce el volumen del gas.
Se puede aplicar la Ley de Boyle-Mariotte a líquidos o sólidos
La Ley de Boyle-Mariotte, también conocida como la Ley de Boyle o la Ley de Mariotte, establece la relación inversa entre la presión y el volumen de un gas a una temperatura constante. Sin embargo, ¿se puede aplicar esta ley también a líquidos o sólidos? Veamos.
En general, la Ley de Boyle-Mariotte se aplica específicamente a las propiedades de los gases debido a su comportamiento más flexible en comparación con los líquidos y los sólidos. Los gases tienen partículas que están muy separadas y en constante movimiento, lo que les permite adaptarse más fácilmente a cambios en la presión y el volumen.
A diferencia de los gases, los líquidos y los sólidos tienen partículas mucho más cercanas y tienen una estructura más organizada. Esto significa que no pueden comprimirse o expandirse como los gases. En lugar de eso, los líquidos y los sólidos son prácticamente incompresibles y mantienen un volumen constante bajo una amplia gama de presiones.
Por lo tanto, en el caso de los líquidos y los sólidos, no es adecuado aplicar directamente la Ley de Boyle-Mariotte, ya que no experimentarán cambios significativos en el volumen en respuesta a cambios en la presión. En lugar de ello, existe otra ley para describir el comportamiento de la presión en estos estados de la materia.
Para los líquidos, existe la Ley de Pascal, que establece que la presión ejercida sobre un líquido se transmite de manera uniforme en todas las direcciones. Esto explica por qué podemos utilizar una jeringa para inyectar un líquido en una vena sin necesidad de aplicar una presión extrema.
En el caso de los sólidos, existe la Ley de Hooke, que establece que la deformación de un sólido es directamente proporcional a la fuerza aplicada sobre él. En otras palabras, cuanto mayor sea la fuerza aplicada sobre un sólido, mayor será la deformación o compresión resultante.
Mientras que la Ley de Boyle-Mariotte se aplica exclusivamente a los gases, existen leyes diferentes para describir el comportamiento de la presión y el volumen en los líquidos y los sólidos. La Ley de Pascal es utilizada para los líquidos, donde la presión se transmite de manera uniforme, y la Ley de Hooke es utilizada para los sólidos, donde la compresión es proporcional a la fuerza aplicada.
Preguntas frecuentes (FAQ)
1. ¿Cuál es la relación entre la presión y el volumen según la ley de Boyle-Mariotte?
La presión y el volumen son inversamente proporcionales: si la presión aumenta, el volumen disminuye, y viceversa.
2. ¿Qué unidades se utilizan para medir la presión en la ley de Boyle-Mariotte?
Generalmente, la presión se mide en Pascales (Pa), aunque también se pueden utilizar otras unidades como atmósferas (atm) o milímetros de mercurio (mmHg).
3. ¿Cómo se aplica la ley de Boyle-Mariotte en la vida cotidiana?
La ley de Boyle-Mariotte explica fenómenos como la inflación de los neumáticos de un automóvil con una bomba de aire o la contracción de una jeringa al extraer líquido.
4. ¿Qué sucede con la temperatura en la ley de Boyle-Mariotte?
La ley de Boyle-Mariotte solo es aplicable si la temperatura permanece constante. Si ocurre algún cambio en la temperatura, la relación entre presión y volumen puede verse afectada.
5. ¿Cuál es la importancia de la ley de Boyle-Mariotte en la ciencia?
La ley de Boyle-Mariotte es fundamental en la comprensión de varios aspectos de la física y la química, como la termodinámica, la cinética de gases y la biología celular.
Deja una respuesta
Entradas relacionadas