Equilibrio dinámico en química: Descubre cómo lograr reacciones perfectamente balanceadas
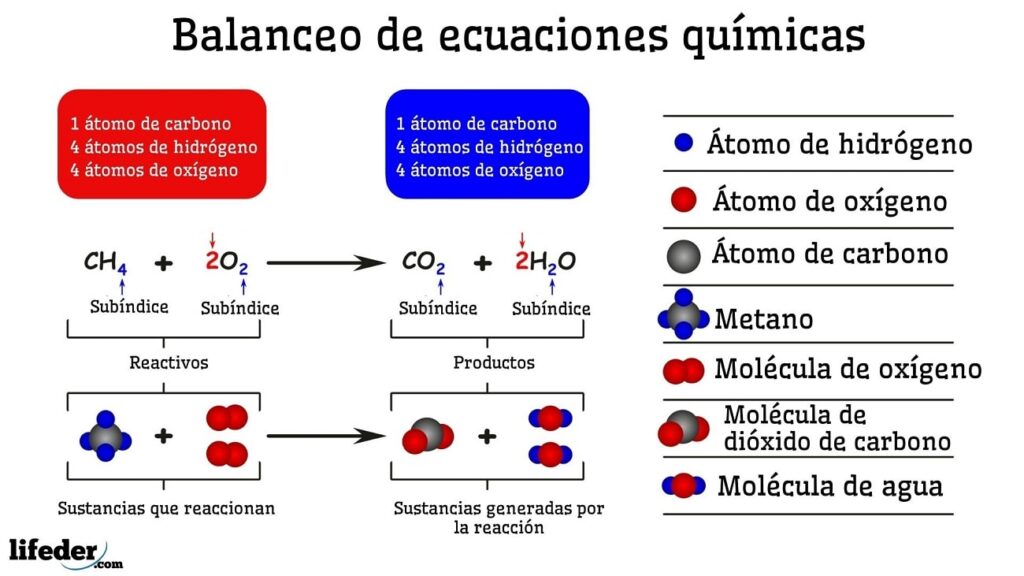
En el estudio de la química, una de las habilidades fundamentales es poder llevar a cabo reacciones químicas en equilibrio dinámico. Este equilibrio se establece cuando la velocidad de la reacción directa es igual a la velocidad de la reacción inversa, lo que resulta en una concentración constante de los productos y reactantes en el sistema.
Exploraremos en detalle qué es el equilibrio dinámico en química y cómo lograrlo utilizando la ley de acción de masas y la constante de equilibrio. Además, veremos ejemplos prácticos de cómo balancear ecuaciones químicas para alcanzar un estado de equilibrio adecuado. ¡Acompáñanos en este fascinante viaje por el mundo del equilibrio químico!
- Qué es el equilibrio dinámico en química y por qué es importante
- Cuáles son las características de una reacción química en equilibrio
- Cuál es la ley del equilibrio químico y cómo se aplica
- Cómo se determina si una reacción está en equilibrio
- Qué factores afectan el equilibrio en una reacción química
- Cuáles son los principios básicos para lograr un equilibrio dinámico en una reacción química
- Qué es el principio de Le Châtelier y cómo se utiliza para desplazar el equilibrio químico
- Cómo se pueden hacer ajustes a las condiciones de una reacción para alcanzar un equilibrio ideal
- Cuáles son las aplicaciones prácticas del equilibrio dinámico en química
- ¿Cuáles son algunos ejemplos y experimentos comunes que ilustran el concepto de equilibrio en reacciones químicas?
Qué es el equilibrio dinámico en química y por qué es importante
El equilibrio dinámico es un concepto fundamental en química que se refiere al estado en el cual las velocidades de las reacciones directa e inversa son iguales, lo que resulta en una concentración constante de los reactantes y productos a lo largo del tiempo. Es importante entender este concepto ya que nos permite predecir el resultado de una reacción química y determinar las condiciones necesarias para lograr un equilibrio estable.
En un sistema en equilibrio dinámico, las moléculas de los reactivos interactúan entre sí y forman productos, al mismo tiempo que los productos se descomponen y vuelven a formar reactivos. Esto crea una situación en la cual no hay un cambio neto en las concentraciones de los reactivos y productos, pero las reacciones continúan ocurriendo a nivel molecular.
La importancia del equilibrio dinámico radica en su aplicación práctica en numerosos aspectos de la química y otras ciencias. Por ejemplo, es esencial para comprender cómo ocurren las reacciones químicas en los procesos industriales, como la producción de productos químicos o la fabricación de medicamentos. Además, el equilibrio dinámico también juega un papel crucial en la bioquímica y en la comprensión de los sistemas biológicos.
El equilibrio dinámico en química es un estado en el cual las velocidades de las reacciones directa e inversa son iguales, lo que resulta en una concentración constante de los reactivos y productos a lo largo del tiempo. Comprender este concepto es esencial para predecir el resultado de una reacción química y para aplicar estos conocimientos en diversos campos de la ciencia.
Cuáles son las características de una reacción química en equilibrio
Cuando una reacción química se encuentra en equilibrio, esto significa que la cantidad de reactivos y productos se mantiene constante a lo largo del tiempo. En otras palabras, las velocidades de reacción en ambos sentidos son iguales, lo que crea un estado de equilibrio dinámico.
En una reacción química en equilibrio, se pueden observar varias características:
1. Concentraciones constantes
En una reacción en equilibrio, las concentraciones de los reactivos y productos se mantienen constantes, aunque estén en continuo proceso de transformación. Esto significa que la cantidad de sustancias presentes no varía a lo largo del tiempo.
2. Velocidades de reacción iguales
En equilibrio, la velocidad de formación de los productos es igual a la velocidad de descomposición de los productos en reactivos. Esto implica que las reacciones directa e inversa ocurren al mismo ritmo, lo que garantiza la estabilidad del sistema.
3. Ausencia de cambios macroscópicos
A simple vista, una reacción en equilibrio parece estar inactiva, ya que no se perciben cambios macroscópicos en el sistema. Sin embargo, a nivel microscópico, las moléculas están en constante movimiento y transformación, manteniendo siempre la misma cantidad de sustancias involucradas.
4. Relación entre concentraciones y coeficientes estequiométricos
En una reacción química en equilibrio, las concentraciones de los reactivos y productos están relacionadas por los coeficientes estequiométricos de la ecuación química balanceada. Esta relación permite establecer una expresión matemática conocida como constante de equilibrio, que representa a las concentraciones en un punto dado del sistema.
A lo largo del tiempo, las condiciones pueden cambiar y alterarse el equilibrio químico. Estas variaciones pueden ser causadas por cambios en la temperatura, presión o concentración de las sustancias involucradas. Sin embargo, el sistema siempre buscará alcanzar un nuevo estado de equilibrio.
Una reacción química en equilibrio se caracteriza por la constancia de las concentraciones, igualdad de las velocidades de reacción, ausencia de cambios macroscópicos y una relación entre las concentraciones y los coeficientes estequiométricos. Estas características son fundamentales para comprender cómo lograr reacciones perfectamente balanceadas y mantener el equilibrio químico en sistemas complejos.
Cuál es la ley del equilibrio químico y cómo se aplica
La ley del equilibrio químico es uno de los principales conceptos en la química que estudia las reacciones químicas y cómo se alcanza un estado de equilibrio entre los productos y los reactivos. Esta ley, también conocida como principio de Le Chatelier, establece que cuando una reacción química está en equilibrio, la velocidad de formación de los productos es igual a la velocidad de formación de los reactivos.
La aplicación de esta ley es fundamental para entender el comportamiento de las reacciones químicas y permitir su optimización. Para lograr un equilibrio químico adecuado, es necesario tener en cuenta diversos factores como la concentración de los reactivos y productos, la presión y temperatura del sistema y las propiedades de los compuestos involucrados.
Factores que afectan al equilibrio químico
1. Concentración: La concentración de los reactivos y productos en una reacción química tiene un impacto directo en el estado de equilibrio. Aumentar la concentración de los reactivos, desplaza el equilibrio hacia la formación de más productos, mientras que disminuir su concentración favorece la formación de más reactivos.
2. Presión: En el caso de reacciones gaseosas, la presión también puede influir en el equilibrio químico. El aumento de la presión favorece la formación de productos en el lado con menos moles gaseosos, según la ley de Le Chatelier. Por otro lado, disminuir la presión favorece la formación de reactivos.
3. Temperatura: La temperatura es un factor crucial en el equilibrio químico, ya que puede afectar significativamente la velocidad de la reacción. Si aumentamos la temperatura, favorecemos la formación de productos en reacciones endotérmicas y la disminución de los mismos en reacciones exotérmicas. Un descenso de la temperatura tendrá el efecto contrario.
Además de estos factores, otros aspectos como el catalizador o la superficie de contacto entre reactivos pueden influir en el equilibrio químico. Es importante tener en cuenta todos estos elementos para garantizar una reacción química eficiente y balanceada.
Cómo se determina si una reacción está en equilibrio
Para determinar si una reacción química está en equilibrio, es necesario analizar las concentraciones de los reactivos y productos en un sistema cerrado. En ese sentido, se debe entender que el equilibrio químico se logra cuando la velocidad de la reacción directa es igual a la velocidad de la reacción inversa.
En general, existen tres criterios principales para determinar si una reacción química está en equilibrio:
- Concentraciones constantes: En una reacción en equilibrio, las concentraciones de los reactivos y productos no cambian en el tiempo. Esto significa que la cantidad de sustancias químicas en el sistema se mantiene constante.
- Presión constante: Si una reacción en equilibrio involucra gases, la presión también debe ser constante. Esto implica que el número total de moles de gas en el sistema no se altera durante la reacción.
- Relación estequiométrica: La relación entre los coeficientes de la ecuación química balanceada indica cómo se relacionan las cantidades de reactivos y productos en una reacción en equilibrio. Esta relación estequiométrica permite establecer las proporciones necesarias para alcanzar el equilibrio.
El principio de Le Chatelier
Un concepto fundamental en el equilibrio químico es el principio de Le Chatelier. Según este principio, cuando un sistema en equilibrio es sometido a un cambio externo, el sistema reaccionará de manera que se contrarreste o minimice dicho cambio.
Este principio se aplica a cambios en la concentración, presión y temperatura del sistema. Si se aumenta la concentración de uno de los reactivos, por ejemplo, el equilibrio se desplazará hacia la formación de productos para compensar ese aumento.
De forma similar, si se disminuye la presión del sistema en equilibrio, el equilibrio se desplazará hacia la dirección que genera un aumento en el número total de moles de gas. Por otro lado, si se incrementa la temperatura del sistema, el equilibrio se desplazará hacia la reacción endotérmica para liberar energía y volver al equilibrio.
Cómo lograr un equilibrio químico perfectamente balanceado
Para lograr un equilibrio químico perfectamente balanceado, es necesario ajustar las condiciones experimentales de manera adecuada. Algunas estrategias comunes incluyen:
- Variar las concentraciones: Incrementando o disminuyendo las concentraciones de los reactivos o productos, se puede manipular el equilibrio hacia una dirección específica. Sin embargo, es importante tener en cuenta que cambios significativos en las concentraciones pueden alterar completamente el equilibrio químico.
- Modificar la presión: Si la reacción se lleva a cabo en un sistema cerrado con gases, se puede modificar la presión del sistema para favorecer la formación de más o menos producto. Esto se puede lograr mediante el uso de recipientes con diferente volumen o utilizando gases inerte para diluir la reacción química.
- Controlar la temperatura: La temperatura juega un papel fundamental en las constantes de equilibrio de una reacción. Aumentar o disminuir la temperatura puede desplazar el equilibrio hacia la formación del producto o hacia los reactivos, respectivamente.
Es importante mencionar que lograr un equilibrio químico perfectamente balanceado puede ser complicado, ya que depende de múltiples factores y condiciones experimentales. Además, es indispensable contar con los conocimientos adecuados sobre las propiedades de los reactivos y productos involucrados en la reacción química.
Qué factores afectan el equilibrio en una reacción química
El equilibrio en una reacción química puede ser afectado por varios factores. Estos factores incluyen:
1. Concentración de los reactivos y productos
La concentración de los reactivos y productos en una reacción química tiene un impacto directo en el equilibrio. Según el principio de Le Chatelier, un aumento en la concentración de los reactivos desplaza el equilibrio hacia la formación de más productos, y viceversa. Por otro lado, disminuir la concentración de los productos también empuja al sistema a producir más productos para compensar el desequilibrio.
2. Presión
En reacciones gaseosas, la presión también puede afectar el equilibrio. Si se aumenta la presión, el equilibrio se desplaza hacia la formación de menos moles de gas para disminuir la presión total del sistema. Por otro lado, si se reduce la presión, el equilibrio se inclina hacia la producción de más moles de gas para compensar el cambio.
3. Temperatura
La temperatura es otro factor clave que influye en el equilibrio químico. Aumentar la temperatura en una reacción endotérmica desplaza el equilibrio hacia la formación de más productos. En cambio, en una reacción exotérmica, el aumento de temperatura favorece la formación de más reactantes. Sin embargo, cuando la temperatura disminuye, el efecto es contrario: una disminución en la temperatura favorece la producción de reactantes en una reacción endotérmica y la formación de productos en una reacción exotérmica.
4. Superficie de contacto
La superficie de contacto entre los reactivos también puede tener un impacto en el equilibrio de una reacción, especialmente en reacciones heterogéneas donde los reactivos se encuentran en diferentes fases (por ejemplo, un sólido y un gas). Un aumento en la superficie de contacto favorece la velocidad de reacción y, por lo tanto, desplaza el equilibrio hacia la formación de más productos.
5. Catalizadores
Los catalizadores son sustancias que aceleran la velocidad de una reacción química sin consumirse en el proceso. Aunque no afectan directamente el equilibrio químico, pueden influir en el tiempo que tarda en alcanzarse el equilibrio. Al aumentar la velocidad de reacción, los catalizadores ayudan a establecer el equilibrio más rápidamente.
El equilibrio químico puede ser afectado por la concentración de los reactantes y productos, la presión, la temperatura, la superficie de contacto y la presencia de catalizadores. Estos factores juegan un papel crucial en la obtención de reacciones perfectamente balanceadas.
Cuáles son los principios básicos para lograr un equilibrio dinámico en una reacción química
Para lograr un equilibrio dinámico en una reacción química, es necesario entender y aplicar ciertos principios básicos. Estos principios se basan en la ley de acción de masas y en el concepto de constantes de equilibrio.
Ley de acción de masas
La ley de acción de masas establece que la velocidad de una reacción química es proporcional al producto de las concentraciones de los reactivos elevados a su coeficiente estequiométrico. Es decir:
Velocidad = k [A]^a [B]^b
donde .y .representan las concentraciones de los reactivos A y B, respectivamente, y a y b son los coeficientes estequiométricos de A y B en la ecuación de reacción. La constante k es la constante de proporcionalidad y depende de la temperatura.
Constantes de equilibrio
Para lograr un equilibrio dinámico, es necesario alcanzar una constante de equilibrio. La constante de equilibrio, representada por K, es la relación entre las concentraciones de productos y reactantes en el estado de equilibrio. Se calcula de la siguiente manera:
K = [C]^c [D]^d / [A]^a [B]^b
donde .y .representan las concentraciones de los productos C y D, respectivamente, y c y d son los coeficientes estequiométricos de C y D en la ecuación de reacción.
Principios para lograr un equilibrio dinámico
Para lograr un equilibrio dinámico en una reacción química, debes seguir los siguientes principios:
- Manipulación de concentraciones: Alterar las concentraciones iniciales de los reactivos o productos puede desplazar el equilibrio hacia la derecha o hacia la izquierda. Aumentar la concentración de los reactivos favorece la formación de productos, mientras que disminuir la concentración de los productos favorece la formación de reactivos.
- Manipulación de presiones: En caso de que la reacción involucre gases, cambiar la presión total del sistema puede afectar el equilibrio. Si se aumenta la presión, el equilibrio se desplaza hacia el lado con menos moles de gas, y si se disminuye la presión, el equilibrio se desplaza hacia el lado con más moles de gas.
- Manipulación de temperaturas: La temperatura también puede influir en el equilibrio. Para reacciones exotérmicas (liberan calor), aumentar la temperatura desplaza el equilibrio hacia la izquierda, mientras que para reacciones endotérmicas (absorben calor), aumentar la temperatura desplaza el equilibrio hacia la derecha.
- Aplicación del principio de Le Chatelier: Este principio establece que, cuando se aplica una tensión a un sistema en equilibrio, éste responde de manera a contrarrestar la tensión aplicada. Por ejemplo, si se añade más reactivo, el sistema consumirá ese reactivo para equilibrarse nuevamente.
Lograr un equilibrio dinámico en una reacción química requiere manipular las concentraciones, presiones y temperaturas de los reactivos y productos, teniendo en cuenta los principios de la ley de acción de masas y las constantes de equilibrio.
Qué es el principio de Le Châtelier y cómo se utiliza para desplazar el equilibrio químico
El principio de Le Châtelier es una regla fundamental en química que nos permite predecir y comprender cómo se desplazará el equilibrio químico frente a cambios en la temperatura, concentración o presión. Este principio establece que cuando un sistema en equilibrio es sometido a una perturbación externa, el sistema se ajustará de manera tal que contrarreste dicha perturbación y restablezca su estado de equilibrio.
En otras palabras, si un sistema está en equilibrio químico y se le agrega algún reactivo o se le retira algún producto, el sistema tenderá a consumir parte de ese reactivo o producir más producto para compensar la alteración y recuperar su equilibrio inicial.
Efecto de la temperatura en el equilibrio químico
La temperatura es un factor muy importante en las reacciones químicas y en el equilibrio de un sistema. De acuerdo con el principio de Le Châtelier, un aumento de temperatura favorecerá a la reacción endotérmica, es decir, aquella en la que se absorbe energía del entorno, mientras que disminuirá la velocidad de las reacciones exotérmicas.
Por otro lado, si se disminuye la temperatura, las reacciones exotérmicas serán favorecidas, ya que se liberará más energía al ambiente, y las reacciones endotérmicas se verán desfavorecidas.
Efecto de la concentración en el equilibrio químico
La concentración de los reactivos y productos también influye en el equilibrio químico de un sistema. Si se agrega una mayor cantidad de reactivo, la reacción buscará desplazarse hacia los productos para compensar el aumento de concentración y volver a su estado de equilibrio.
Por otro lado, si se aumenta la concentración de los productos de una reacción, el equilibrio se desplazará hacia los reactivos para contrarrestar el aumento y mantener el balance del sistema.
Efecto de la presión en el equilibrio químico
La presión también puede afectar el equilibrio químico de sistemas gaseosos. Según el principio de Le Châtelier, si se aumenta la presión total del sistema, este tenderá a moverse hacia el lado donde haya menos moles de gas, ya que esto reduce la presión ejercida por las partículas gaseosas.
De manera contraria, si se disminuye la presión, el sistema se desplazará hacia el lado con mayor número de moles de gas para aumentar la presión total.
El principio de Le Châtelier nos permite comprender cómo un sistema en equilibrio químico reacciona ante cambios en la temperatura, concentración o presión. Conociendo estos efectos, podemos utilizar estas alteraciones externas para desplazar el equilibrio en nuestra dirección deseada y lograr reacciones perfectamente balanceadas.
Cómo se pueden hacer ajustes a las condiciones de una reacción para alcanzar un equilibrio ideal
El equilibrio dinámico en química es un proceso fundamental para lograr reacciones químicas perfectamente balanceadas. Para alcanzar este equilibrio, es necesario ajustar cuidadosamente las condiciones de la reacción, como la temperatura, la presión y la concentración de los reactivos. En esta sección, exploraremos cómo se pueden hacer estos ajustes y cómo afectan el equilibrio de la reacción.
Ajuste de la temperatura
La temperatura es uno de los factores clave que afecta el equilibrio de una reacción química. Aumentar la temperatura generalmente favorece las reacciones endotérmicas, aquellas en las que se absorbe energía del entorno, mientras que disminuir la temperatura favorece las reacciones exotérmicas, aquellas en las que se libera energía al entorno. En algunos casos, el equilibrio puede desplazarse en ambas direcciones dependiendo de la temperatura. Por ejemplo, en la reacción de formación del amoníaco (NH3), un aumento de temperatura favorecerá la formación de productos, mientras que una disminución de temperatura favorecerá la formación de los reactivos:
N2 + 3H2 ⇌ 2NH3
Ajuste de la presión
La presión también puede influir en el equilibrio de una reacción, especialmente cuando hay gases involucrados. Según el principio de Le Chatelier, si se aumenta la presión, el equilibrio se desplazará hacia el lado con menos moles de gas. Por el contrario, si se disminuye la presión, el equilibrio se desplazará hacia el lado con más moles de gas. Por ejemplo, consideremos la reacción del equilibrio de formación del dióxido de carbono (CO2):
C(s) + O2(g) ⇌ CO2(g)
Si aumentamos la presión, el equilibrio se desplazará hacia la formación de CO2, ya que solo hay un mol de gas en el lado de los productos, mientras que hay dos moles de gases en el lado de los reactivos.
Ajuste de la concentración de reactivos
Modificar la concentración de los reactivos también puede influir en el equilibrio de una reacción química. Si aumentamos la concentración de los reactivos, el equilibrio se desplazará hacia la formación de productos para contrarrestar esta alteración. Por otro lado, si disminuimos la concentración de los reactivos, el equilibrio se desplazará hacia la formación de reactivos. Es importante tener en cuenta la estequiometría de la reacción al ajustar las concentraciones para lograr un equilibrio ideal.
El equilibrio dinámico en química se puede alcanzar mediante el ajuste cuidadoso de las condiciones de la reacción. La temperatura, la presión y la concentración de reactivos son factores clave que pueden desplazar el equilibrio hacia la formación de productos o reactivos. Comprender cómo realizar estos ajustes es fundamental para lograr reacciones químicas perfectamente balanceadas y mantener un equilibrio ideal.
Cuáles son las aplicaciones prácticas del equilibrio dinámico en química
El equilibrio dinámico en química tiene numerosas aplicaciones prácticas que son de gran importancia en diferentes campos. A continuación, vamos a explorar algunas de ellas:
1. Diseño de procesos químicos
El equilibrio dinámico es fundamental en el diseño de procesos químicos, ya que permite optimizar las condiciones necesarias para obtener las reacciones deseadas. Conociendo el equilibrio entre las especies involucradas, es posible determinar el tamaño de los reactores, las concentraciones óptimas de reactivos y productos, así como las temperaturas y presiones adecuadas para maximizar el rendimiento.
2. Producción de energía
En la industria eléctrica, el equilibrio dinámico es clave para el funcionamiento de las celdas electroquímicas, como las pilas y las baterías. Estos dispositivos aprovechan el equilibrio entre las especies presentes en los electrodos para generar electricidad. La comprensión del equilibrio químico es esencial para mejorar la eficiencia y durabilidad de estas fuentes de energía.
3. Farmacología y medicina
La cinética enzimática y farmacológica se basa en el equilibrio dinámico de las reacciones bioquímicas. El conocimiento sobre el equilibrio entre sustratos, productos e inhibidores permite entender cómo se llevan a cabo las transformaciones químicas dentro del organismo. Esto resulta crucial para el descubrimiento y desarrollo de fármacos, así como para comprender los efectos de las drogas en el cuerpo.
4. Control de la contaminación
El equilibrio dinámico se aplica en el control de la contaminación, específicamente en el tratamiento de aguas residuales y gases contaminantes. Mediante reacciones químicas adecuadas, es posible lograr una transformación completa de los compuestos nocivos en sustancias inofensivas, manteniendo así un equilibrio saludable en el medio ambiente.
5. Análisis químico
En el ámbito del análisis químico, el equilibrio dinámico es utilizado para determinar la concentración de diferentes componentes presentes en una muestra. Esto se logra mediante técnicas como la espectrofotometría, que aprovecha los cambios en la concentración de especies químicas en equilibrio para obtener información cuantitativa sobre la composición de una muestra desconocida.
6. Industria alimentaria
En la industria alimentaria, el conocimiento del equilibrio dinámico es esencial para la producción de alimentos seguros y de alta calidad. Por ejemplo, en la fabricación de cerveza, el equilibrio entre las levaduras y los carbohidratos presentes en el mosto es necesario para garantizar la fermentación adecuada y obtener la cantidad deseada de alcohol. Además, en la conservación de alimentos, el control del equilibrio microbiológico ayuda a prevenir el crecimiento de microorganismos dañinos.
7. Desarrollo de materiales
El equilibrio dinámico también juega un papel importante en el desarrollo de nuevos materiales. Al comprender cómo ocurren y se mantienen las transformaciones químicas, es posible diseñar y sintetizar materiales con propiedades específicas. Por ejemplo, en la fabricación de polímeros, el control del equilibrio entre los monómeros y los productos de reacción permite obtener materiales con diferentes grados de reticulación y propiedades mecánicas.
El equilibrio dinámico es una herramienta fundamental en química con aplicaciones prácticas en diversos campos. Desde el diseño de procesos químicos hasta la fabricación de materiales y el control de contaminantes, comprender y aprovechar el equilibrio químico nos permite desarrollar soluciones más eficientes y sustentables.
¿Cuáles son algunos ejemplos y experimentos comunes que ilustran el concepto de equilibrio en reacciones químicas?
El equilibrio en reacciones químicas es un concepto fundamental en la química que se refiere a un estado en el cual las velocidades de las reacciones directa e inversa son iguales. Esto significa que no hay cambios netos en las concentraciones de los reactantes y productos a lo largo del tiempo.
Existen varios ejemplos y experimentos comunes que ilustran este concepto de equilibrio en la química. Uno de estos ejemplos es el equilibrio entre el vapor de agua y el agua líquida. Cuando se coloca agua en un recipiente abierto, el agua se evaporará gradualmente hasta que la cantidad de vapor de agua en el aire sea igual a la cantidad de agua líquida restante. En este punto, se ha alcanzado un equilibrio y la tasa de condensación del vapor de agua es igual a la tasa de evaporación.
Otro ejemplo común de equilibrio químico es la reacción entre el ácido acético y el etanol para formar ester (acetato de etilo) y agua. Esta reacción se puede visualizar utilizando un experimento llamado "la síntesis del acetato de etilo". Se mezclan cantidades equimolares de ácido acético y etanol en presencia de ácido sulfúrico como catalizador. A medida que la reacción avanza, se observa la formación de una capa superior de éster, que puede ser separada por destilación. Sin embargo, aunque se siga añadiendo más ácido acético y etanol, la cantidad de éster formado se mantendrá constante una vez que se haya alcanzado el equilibrio.
Además de los ejemplos mencionados, hay muchos otros experimentos que demuestran el equilibrio en reacciones químicas. Estos incluyen la reacción entre el oxígeno y el hidrógeno para formar agua, la disociación del ácido acético en agua y acetato, y la descomposición del dióxido de nitrógeno en óxido nitroso y oxígeno, entre otros.
El concepto de equilibrio en química es de suma importancia para comprender cómo funcionan las reacciones químicas. A través de ejemplos y experimentos comunes, podemos visualizar y estudiar este equilibrio, lo que nos permite obtener un mayor entendimiento sobre las reacciones perfectamente balanceadas.
El equilibrio químico garantiza que la cantidad de reactantes y productos se mantenga constante, lo que permite obtener mejores rendimientos en las reacciones.
Una reacción química está en equilibrio cuando las concentraciones de los reactivos y productos no cambian con el tiempo.
El equilibrio de una reacción se puede modificar mediante cambios en la temperatura, presión o concentración de los reactivos o productos.
El principio de Le Chatelier establece que si se aplica un cambio a un sistema en equilibrio, este responderá de manera que contrarreste el efecto del cambio.
Los catalizadores aceleran las reacciones químicas sin ser consumidos, lo que puede afectar el equilibrio al aumentar la velocidad de formación de productos.
Deja una respuesta
Entradas relacionadas