Familia en la Tabla Periódica: Descubre la Importancia y Características
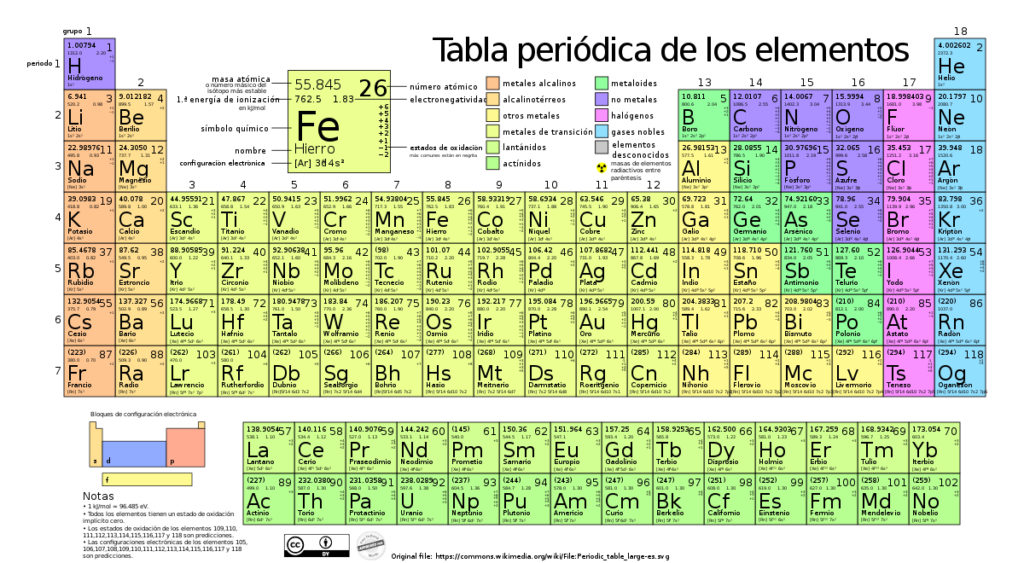
La tabla periódica es una herramienta fundamental en el estudio de la química. Organiza los elementos químicos de acuerdo a sus propiedades y estructuras, permitiendo visualizar las relaciones entre ellos de manera clara y precisa. Dentro de la tabla periódica, existen diferentes grupos o familias de elementos que comparten características similares y se ubican en una misma columna. Estas familias tienen importancia en términos de reactividad química, propiedades físicas y comportamiento orbital.
Exploraremos la importancia de las familias en la tabla periódica y cómo estas ayudan a comprender y predecir el comportamiento de los elementos químicos. También analizaremos algunas de las familias más importantes, como los metales alcalinos, los metales alcalinotérreos, los halógenos y los gases nobles, destacando sus propiedades y aplicaciones relevantes. Además, discutiremos por qué es relevante estudiar las familias en la tabla periódica y cómo esta información nos permite entender mejor la química y su impacto en nuestra vida cotidiana.
- Cuál es la importancia de la familia en la tabla periódica
- Cuáles son las características principales de los elementos pertenecientes a una familia en la tabla periódica
- Cómo se clasifican las familias en la tabla periódica
- Cuál es la diferencia entre una familia y un grupo en la tabla periódica
- Qué elementos pertenecen a la familia de los metales alcalinos
- Cuáles son las propiedades especiales de los elementos de la familia de los halógenos
- Por qué es importante estudiar la relación entre los elementos de una familia en la tabla periódica
- Cómo podemos identificar los elementos pertenecientes a una familia en la tabla periódica
- De qué manera influyen las características de una familia en las reacciones químicas
- Cuál es el concepto de valencia y cómo se relaciona con las familias en la tabla periódica
Cuál es la importancia de la familia en la tabla periódica
La familia en la tabla periódica es un concepto fundamental en la química y tiene una gran importancia tanto teórica como práctica. Una familia, también conocida como grupo o columna, es un conjunto de elementos que comparten características químicas similares debido a su configuración electrónica.
Las familias se clasifican en base al número de electrones en el nivel de energía más externo, también conocido como capa de valencia. Estos electrones determinan la reactividad y propiedades químicas de los elementos. Por lo tanto, comprender las familias en la tabla periódica nos ayuda a predecir cómo interactúan los elementos entre sí y cómo forman compuestos.
Además, la tabla periódica organiza los elementos de manera sistemática, agrupándolos en filas y columnas según sus propiedades. Gracias a esto, podemos identificar patrones y tendencias en las propiedades de los elementos en función de su ubicación en la tabla. Las familias son una de estas formas de organización y proporcionan una forma conveniente de categorizar los elementos.
Otra razón por la cual las familias son importantes es que muchos de sus elementos tienen aplicaciones prácticas en nuestra vida diaria. Por ejemplo, la familia de los metales alcalinos, que incluye elementos como el sodio y el potasio, son altamente reactivos y se utilizan en la fabricación de baterías, productos farmacéuticos y productos químicos industriales.
Entender y utilizar la información sobre las familias en la tabla periódica es esencial para comprender la química y sus aplicaciones. Nos permite predecir la reactividad de los elementos, identificar patrones en las propiedades y utilizar eficientemente los elementos en diferentes industrias. Es por eso que la familia en la tabla periódica tiene una importancia significativa tanto en el campo científico como en el ámbito práctico.
Cuáles son las características principales de los elementos pertenecientes a una familia en la tabla periódica
Las familias en la tabla periódica se refieren a grupos de elementos que comparten características similares y propiedades químicas. Estos grupos están organizados verticalmente en la tabla periódica y cada uno está identificado por un número romano y una letra.
Existen diferentes familias en la tabla periódica, como los metales alcalinos (grupo 1), los metales alcalinotérreos (grupo 2), los halógenos (grupo 17) y los gases nobles (grupo 18), entre otros. Cada familia tiene sus propias características distintivas que los diferencian de otros elementos.
Metales Alcalinos (Grupo 1)
Los metales alcalinos son muy reactivos y tienden a perder fácilmente un electrón para formar cationes con carga positiva. Son suaves, tienen baja densidad y puntos de fusión relativamente bajos. Además, son buenos conductores de electricidad y tienen una apariencia plateada.
Metales Alcalinotérreos (Grupo 2)
Los metales alcalinotérreos también son reactivos, aunque no tanto como los metales alcalinos. Tienen dos electrones de valencia que pueden perder para formar cationes con carga positiva. Al igual que los metales alcalinos, son buenos conductores de electricidad y tienen una apariencia plateada.
Halógenos (Grupo 17)
Los halógenos son altamente reactivos y tienen una gran afinidad por los electrones. Tienen una electronegatividad alta y suelen formar aniones con carga negativa al ganar un electrón. Son no metales y se encuentran en estado gaseoso, líquido o sólido a temperatura ambiente.
Gases Nobles (Grupo 18)
Los gases nobles son elementos químicamente inertes, lo que significa que no reaccionan fácilmente con otros elementos. Tienen una estructura de electrones completa en su capa de valencia y en su mayoría se encuentran en estado gaseoso a temperatura ambiente. Entre sus características destacadas se encuentra su baja reactividad y su falta de color y olor.
Cabe destacar que estas son solo algunas de las familias en la tabla periódica y cada una tiene características específicas que los distinguen. Comprender y reconocer las propiedades de cada familia es fundamental en el estudio de la química y nos ayuda a entender cómo interactúan los elementos entre sí.
Cómo se clasifican las familias en la tabla periódica
La tabla periódica es una herramienta fundamental en la química, ya que nos proporciona una organización y clasificación de los elementos químicos conocidos. Una de las formas en las que se clasifican los elementos en la tabla periódica es a través de las familias.
Las familias en la tabla periódica son grupos de elementos que comparten características similares en cuanto a su estructura atómica y propiedades químicas. Estas características comunes se deben a la disposición de los electrones en los niveles y subniveles energéticos.
Tipos de familias en la tabla periódica
Existen varios tipos de familias en la tabla periódica, cada una con sus propias particularidades. Algunas de las familias más conocidas son:
- Familia de los metales alcalinos: esta familia está formada por los elementos del grupo 1, con excepción del hidrógeno. Son metales altamente reactivos y suelen ser blandos en estado puro.
- Familia de los metales alcalinotérreos: esta familia está formada por los elementos del grupo 2. También son metales, pero menos reactivos que los metales alcalinos. Tienen mayor dureza y puntos de fusión más altos.
- Familia de los halógenos: esta familia está formada por los elementos del grupo 17. Son no metales altamente reactivos y suelen encontrarse en forma de moléculas diatómicas. Son muy utilizados en la industria química.
- Familia de los gases nobles: esta familia está formada por los elementos del grupo 18. Son gases extremadamente estables y poco reactivos. Tienen una configuración electrónica completa en su nivel más externo.
Estos son solo ejemplos de algunas familias en la tabla periódica, pero existen muchas más. Cada familia tiene características únicas que la distinguen del resto, lo que resulta de gran importancia para comprender las propiedades químicas de los elementos y cómo se relacionan entre sí.
Importancia de las familias en la tabla periódica
El estudio de las familias en la tabla periódica es fundamental para la química, ya que nos permite predecir el comportamiento químico de los elementos. Al conocer las propiedades comunes de una familia, podemos inferir las propiedades de otros elementos pertenecientes a esa misma familia.
Además, la clasificación en familias nos ayuda a organizar la vasta cantidad de elementos químicos conocidos. Si tuviéramos que estudiar cada elemento individualmente, sería una tarea muy compleja y tediosa. Gracias a las familias, podemos agrupar elementos con características similares y facilitar así su estudio y comprensión.
Las familias en la tabla periódica nos permiten organizar y clasificar los elementos químicos según sus características y propiedades comunes. Esto resulta de gran importancia para el estudio y comprensión de la química, ya que nos facilita la predicción del comportamiento de los elementos y nos ayuda a organizar el vasto mundo de los elementos químicos.
Cuál es la diferencia entre una familia y un grupo en la tabla periódica
En la tabla periódica, los términos "familia" y "grupo" se utilizan a menudo de manera intercambiable para describir conjuntos de elementos con características similares. Sin embargo, hay una pequeña diferencia entre estos dos conceptos.
En la tabla periódica, los elementos se organizan en filas horizontales llamadas periodos y columnas verticales llamadas grupos o familias. Los grupos son las columnas que van desde el 1 al 18 y se encuentran en la parte superior de la tabla. Por otro lado, las filas horizontales o periodos atraviesan la tabla de izquierda a derecha.
La principal diferencia entre una familia y un grupo en la tabla periódica radica en su estructura y clasificación. Un grupo se define como una columna vertical en la tabla periódica que contiene elementos con propiedades químicas similares. Estos elementos comparten el mismo número de electrones en sus niveles energéticos externos y, por lo tanto, exhiben patrones de comportamiento químico y propiedades similares. Las familias, por otro lado, son grupos especiales dentro de los grupos donde los elementos tienen características aún más similares.
Incluso dentro de un grupo específico, los elementos pueden tener diferencias sutiles en sus propiedades físicas y químicas debido a variaciones en su tamaño, masa atómica o configuración electrónica, pero en general, los elementos de un grupo exhiben tendencias similares en cuanto a reactividad química, estados de oxidación, radio atómico y otros parámetros. Los grupos son especialmente útiles para predecir propiedades químicas de elementos desconocidos y para entender las tendencias periódicas a medida que se desplazan de arriba a abajo en un grupo específico.
Por otro lado, las familias son subdivisiones más específicas dentro de los grupos y suelen recibir nombres especiales. Estos nombres a menudo se basan en el primer elemento del grupo o en características químicas particulares. Por ejemplo, la columna 1 (Grupo IA) es conocida como la familia de los metales alcalinos y la columna 18 (Grupo VIIIA) es conocida como los gases nobles.
Mientras que los grupos representan columnas verticales en la tabla periódica y contienen elementos con características químicas similares, las familias son subconjuntos específicos de elementos dentro de los grupos que comparten aún más similitudes y a menudo tienen nombres especiales asociados.
Qué elementos pertenecen a la familia de los metales alcalinos
Los elementos que pertenecen a la familia de los metales alcalinos en la tabla periódica son: el litio (Li), el sodio (Na), el potasio (K), el rubidio (Rb), el cesio (Cs) y el francio (Fr).
Estos elementos se encuentran en el grupo 1A de la tabla periódica y se caracterizan por tener un solo electrón de valencia en su capa más externa. Además, presentan propiedades químicas y físicas similares debido a su configuración electrónica.
Propiedades de los metales alcalinos
- Reactividad: Los metales alcalinos son extremadamente reactivos, especialmente cuando están en contacto con el agua o el oxígeno del aire. Esta reactividad se debe a que tienen una alta tendencia a perder su único electrón de valencia para formar cationes positivos.
- Baja densidad: La mayoría de los metales alcalinos tienen una densidad bastante baja, lo que significa que son menos pesados que otros metales. Por ejemplo, el litio, el metal alcalino más ligero, es el metal con menor densidad conocido.
- Bajo punto de fusión y ebullición: Los metales alcalinos tienen puntos de fusión y ebullición relativamente bajos en comparación con otros metales. Esto se debe a las fuerzas de atracción débiles entre sus iones positivos y los electrones libres.
- Conductividad eléctrica y térmica: Los metales alcalinos son buenos conductores de electricidad y calor debido a la presencia de electrones libres en su estructura atómica. Estos electrones pueden moverse libremente, lo que facilita el transporte de cargas eléctricas y energía térmica.
Los metales alcalinos son una familia de elementos químicos altamente reactivos y con propiedades físicas distintivas. Su reactividad y baja densidad los hacen útiles en diversas aplicaciones industriales y científicas.
Cuáles son las propiedades especiales de los elementos de la familia de los halógenos
Los halógenos son una familia de elementos químicos que se encuentran en la tabla periódica. Comprenden los elementos flúor, cloro, bromo, yodo y astato. Esta familia es especialmente interesante debido a las propiedades únicas que poseen.
Elevada reactividad
Una de las características más destacadas de los halógenos es su alta reactividad. Estos elementos tienen una tendencia a ganar un electrón para adquirir una configuración electrónica estable. Esto significa que son capaces de formar enlaces químicos con gran facilidad. Por eso, los halógenos suelen encontrarse combinados con otros elementos, formando compuestos conocidos como haluros.
Alta electronegatividad
Otra propiedad importante de los halógenos es su alta electronegatividad. Esto implica que tienen una gran afinidad por los electrones, lo que les permite atraerlos hacia sí mismos cuando forman enlaces. Como resultado, los halógenos tienden a ser muy buenos oxidantes. Además, esta alta electronegatividad también está relacionada con su capacidad para formar enlaces covalentes polarizados.
Bajos puntos de ebullición y fusión
Los halógenos presentan puntos de ebullición y fusión relativamente bajos en comparación con otros elementos. Esto se debe a las fuerzas intermoleculares débiles que existen entre sus moléculas. Debido a esto, los halógenos son gaseosos en condiciones normales, a excepción del yodo y el astato que son sólidos. De hecho, a temperatura ambiente, únicamente podemos encontrar al flúor y cloro en estado gaseoso.
Coloridos y volátiles
Varios de los halógenos exhiben colores característicos en estado gaseoso o líquido. Por ejemplo, el cloro tiene un color verde amarillento, el bromo es rojo oscuro y el yodo tiene un tono púrpura intenso. Además, los halógenos son altamente volátiles, es decir, se evaporan fácilmente y forman vapores. Esto se debe a sus bajas masas moleculares y a las fuerzas intermoleculares débiles ya mencionadas.
La familia de los halógenos muestra una serie de propiedades fascinantes. Su alta reactividad, electronegatividad, bajos puntos de ebullición y fusión, así como su color y volatilidad, los hacen elementos únicos en la tabla periódica. Estas características tienen aplicaciones importantes en varios campos de la ciencia y la tecnología, lo que demuestra la relevancia y el interés académico en estos elementos.
Por qué es importante estudiar la relación entre los elementos de una familia en la tabla periódica
Es fundamental estudiar la relación entre los elementos de una familia en la tabla periódica, ya que nos permite comprender mejor las propiedades y comportamientos de los diferentes elementos químicos. Esto nos ayuda a encontrar patrones y establecer relaciones entre ellos, lo que a su vez nos permite predecir el comportamiento de elementos desconocidos.
Las familias en la tabla periódica son grupos de elementos que tienen características y propiedades similares. Estas similitudes se deben a que los elementos de una misma familia tienen la misma cantidad de electrones en su capa de valencia, lo que determina su reactividad y propiedades químicas.
Al estudiar la relación entre los elementos de una familia, podemos identificar tendencias y patrones en términos de tamaño atómico, energía de ionización, electronegatividad y otros aspectos fundamentales. Por ejemplo, en el grupo de los metales alcalinos, todos los elementos tienen un solo electrón en su capa de valencia y tienden a perderlo fácilmente para formar cationes con carga +1. Esta tendencia se mantiene a medida que nos desplazamos hacia abajo en el grupo, lo que indica que existe una relación directa entre la reactividad de estos elementos y su posición en la tabla periódica.
Otro aspecto importante de estudiar las familias en la tabla periódica es su impacto en la química orgánica. Al buscar las características comunes entre los elementos de una misma familia, podemos entender mejor la reactividad de los compuestos orgánicos y predecir cómo estos interactuarán entre sí. Por ejemplo, los halógenos son conocidos por su alta electronegatividad y tendencia a aceptar electrones, lo que los hace reactivos en la formación de enlaces covalentes.
Además, al comprender las similitudes y diferencias entre elementos de una misma familia, podemos utilizar esta información para clasificar nuevos elementos y predecir sus propiedades. La tabla periódica es una herramienta invaluable para los químicos, ya que nos permite organizar los elementos de manera sistemática y lógica, lo que facilita el estudio de la química y el desarrollo de nuevas aplicaciones.
Cómo podemos identificar los elementos pertenecientes a una familia en la tabla periódica
Para identificar los elementos pertenecientes a una familia en la tabla periódica, es necesario tener en cuenta su posición y sus características compartidas. En la tabla periódica, los elementos se organizan en filas horizontales llamadas periodos y en columnas verticales llamadas grupos o familias.
Cada familia tiene un número y un nombre específico que ayuda a identificarla. Estas familias se dividen en dos grandes categorías: las familias principales (también llamadas grupos A) y las familias de transición (también conocidas como grupos B).
Familias principales
Las familias principales, que se encuentran en la parte izquierda y derecha de la tabla periódica, son las más conocidas y estudiadas. Estas familias incluyen:
- Familia del hidrógeno (Grupo 1)
- Familia de los metales alcalinos (Grupo 1)
- Familia de los metales alcalinotérreos (Grupo 2)
- Familia del boro (Grupo 13)
- Familia del carbono (Grupo 14)
- Familia del nitrógeno (Grupo 15)
- Familia del oxígeno (Grupo 16)
- Familia de los halógenos (Grupo 17)
- Familia de los gases nobles (Grupo 18)
Cada familia principal tiene características especiales que le otorgan propiedades particulares a los elementos que la componen. Por ejemplo, la familia de los metales alcalinos se caracteriza por tener baja densidad y ser altamente reactivos con el agua, mientras que la familia de los gases nobles son elementos inertes y no reactivo.
Familias de transición
Las familias de transición se encuentran en la parte central de la tabla periódica y están compuestas por elementos de los grupos B. Estas familias incluyen:
- Familia del escandio (Grupo 3)
- Familia del titanio (Grupo 4)
- Familia del vanadio (Grupo 5)
- Familia del cromo (Grupo 6)
- Familia del manganeso (Grupo 7)
- Familia del hierro (Grupo 8)
- Familia del cobalto (Grupo 9)
- Familia del níquel (Grupo 10)
- Familia del cobre (Grupo 11)
- Familia del zinc (Grupo 12)
Estas familias tienen características similares dentro de ellas, pero sus propiedades pueden variar más ampliamente que las familias principales.
Para identificar los elementos pertenecientes a una familia en la tabla periódica, es necesario conocer su posición y nombre específico. Las familias principales se encuentran en la parte izquierda y derecha de la tabla, mientras que las familias de transición se ubican en el centro. Cada familia tiene características y propiedades particulares que los distinguen de otros elementos.
De qué manera influyen las características de una familia en las reacciones químicas
Las características de una familia en la tabla periódica juegan un papel fundamental en las reacciones químicas. La palabra "familia" se refiere a un grupo de elementos que comparten características similares y se encuentran ubicados en la misma columna de la tabla.
Cuando dos o más elementos de una misma familia interactúan entre sí, es probable que experimenten reacciones químicas similares debido a sus propiedades compartidas. Esto se debe a que los elementos de una misma familia tienen una configuración electrónica similar, lo que determina su comportamiento químico.
Importancia de las características familiares en las reacciones químicas
Las características de una familia en la tabla periódica son de gran importancia en las reacciones químicas por varias razones:
- Propiedades físicas y químicas similares: Los elementos de una misma familia tienden a presentar propiedades físicas y químicas similares. Por ejemplo, los metales alcalinos (grupo 1) son altamente reactivos y tienen baja densidad, mientras que los halógenos (grupo 17) son no metales y tienen una alta electronegatividad. Estas propiedades similares hacen que los elementos de la misma familia reaccionen de maneras predecibles.
- Formación de compuestos: La similitud en las propiedades químicas de los elementos de una misma familia facilita la formación de compuestos químicos. Por ejemplo, los halógenos (grupo 17) tienen una alta afinidad por los electrones y tienden a formar compuestos iónicos con los metales alcalinos (grupo 1). Al comprender las características de una familia en particular, se puede predecir qué tipo de compuestos pueden formarse.
- Reactividad: La reactividad química de los elementos está influenciada por su posición dentro de una familia en la tabla periódica. Por ejemplo, a medida que se desciende en el grupo de los halógenos (de fluor a yodo), la reactividad disminuye debido al aumento en el tamaño del átomo y la disminución en la electronegatividad. Esto significa que el flúor es más reactivo que el cloro y así sucesivamente. Comprender estas tendencias en la reactividad permite predecir cómo un elemento de una familia dada puede reaccionar con otros elementos.
Las características de una familia en la tabla periódica son fundamentales para comprender el comportamiento químico de los elementos. Estas características determinan propiedades físicas y químicas similares, facilitan la formación de compuestos y influyen en la reactividad de los elementos. El estudio de las familias en la tabla periódica es crucial para entender cómo ocurren las reacciones químicas y para predecir sus resultados.
Cuál es el concepto de valencia y cómo se relaciona con las familias en la tabla periódica
El concepto de valencia en química se refiere a la capacidad de un átomo para combinar y formar enlaces con otros átomos. Especifica el número de electrones que un átomo puede ganar, perder o compartir durante una reacción química. La valencia es fundamental para determinar las propiedades químicas de los elementos y su posición en la tabla periódica.
En la tabla periódica, los elementos están organizados en varias filas horizontales llamadas periodos y en columnas verticales llamadas grupos o familias. Cada familia tiene características similares debido a la cantidad de electrones en la capa externa del átomo, también conocida como capa de valencia.
Características de las familias en la tabla periódica
Cada familia en la tabla periódica tiene propiedades químicas y comportamientos similares debido a que comparten la misma cantidad de electrones de valencia. A continuación, se describen algunas de las familias más importantes y sus características:
- Familia del hidrógeno: Esta familia solo contiene el elemento hidrógeno. El hidrógeno es especial porque su configuración electrónica difiere de las demás familias, por lo que no se clasifica en un grupo específico.
- Familia de los metales alcalinos: Esta familia incluye los elementos litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Tienen un único electrón de valencia y son altamente reactivos, especialmente cuando se exponen al agua.
- Familia de los metales alcalinotérreos: Esta familia incluye los elementos berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Tienen dos electrones de valencia y son metales ligeros y altamente reactivos.
- Familias del bloque p: Estas familias se encuentran en la parte central y derecha de la tabla periódica. Incluyen la familia del boro, carbono, nitrógeno, oxígeno, fluor y halógenos como el cloro. Los elementos en estas familias pueden ganar, perder o compartir hasta ocho electrones en su capa de valencia.
- Familia de los metales de transición: Esta familia es bastante grande y consta de varios grupos. Los elementos de transición tienen diferentes configuraciones de electrones de valencia y pueden formar múltiples estados de oxidación. Son conocidos por sus propiedades metálicas y su capacidad para formar compuestos coloreados.
- Familia de los gases nobles: Esta familia incluye helio (He), neón (Ne), argón (Ar), criptón (Kr), xenón (Xe) y radón (Rn). Los gases nobles tienen una completa configuración electrónica en su capa de valencia y son extremadamente estables y no reactivos.
Estas son solo algunas de las familias más conocidas en la tabla periódica, pero hay muchas otras con sus propias características químicas únicas. El estudio de las familias en la tabla periódica es esencial para comprender las propiedades y comportamientos de los elementos, lo que a su vez nos permite entender mejor el mundo que nos rodea.
Una familia en la tabla periódica es un grupo de elementos con características químicas similares debido a su configuración electrónica.
Existen 18 familias en la tabla periódica, incluyendo los grupos principales y los grupos de transición.
Las familias en la tabla periódica ayudan a predecir propiedades físicas y químicas de los elementos, así como su reactividad y comportamiento.
Una de las familias más conocidas de la tabla periódica es la familia del carbono, que incluye al carbono, al silicio y al germanio, entre otros elementos.
Las dos filas separadas en la tabla periódica se llaman "lantánidos" y "actínidos".
Deja una respuesta
Entradas relacionadas